NCERT Solutions Class 9 विज्ञान Chapter-4 (परमाणु की संरचना)
Class 9 विज्ञान
पाठ-4 (परमाणु की संरचना)
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
पाठ-4 (परमाणु की संरचना)
पाठ्य – पुस्तक के प्रश्नोत्तर
पाठगत प्रश्न (पृष्ठ संख्या – 53)
प्रश्न 1.
केनाल किरणें क्या हैं ?
उत्तर-
केनाल किरणें- जब विसर्जन नलिका में बहुत कम दाब पर छिद्र युक्त कैथोड लेकर विद्युत विसर्जन किया जाता है तो छिद्र युक्त कैथोड से एक प्रकार की किरणें निकलती हैं जिनकी दिशा कैथोड किरणों के विपरीत होती है। ये किरणें धनावेशित कणों से मिलकर बनी होती हैं। जिन्हें प्रोटॉन कहा गया। इनका द्रव्यमान हाइड्रोजन के एक परमाणु के द्रव्यमान के बराबर पाया गया।
प्रश्न 2.
यदि किसी परमाणु में एक इलेक्ट्रॉन तथा एक प्रोटॉन है तो उसमें कोई आवेश होगा या नहीं ?
उत्तर-
यदि किसी परमाणु में एक इलेक्ट्रॉन तथा एक प्रोटॉन होगा, तो उस पर कोई आवेश नहीं होगा क्योंकि इलेक्ट्रॉन पर उपस्थित ऋण आवेश प्रोटॉन पर उपस्थित धन आवेश को उदासीन कर देगा।
पाठगत प्रश्न (पृष्ठ संख्या – 56)
प्रश्न 1.
परमाणु उदासीन है, इस तथ्य को टामसन के मॉडल के आधार पर स्पष्ट कीजिए।
उत्तर-
टॉमसन के परमाणे मॉडल के अनुसार परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॉन उसमें फँसे होते हैं। क्योंकि धनात्मक आवेश तथा इलेक्ट्रॉन पर उपस्थित ऋणात्मक आवेश परिमाण में समान होते हैं।
अतः परमाणु उदासीन होता है।
प्रश्न 2.
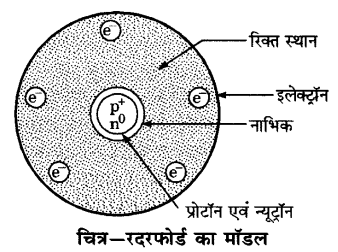
रदरफोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन-सा अवपरमाणुक कण विद्यमान है?
उत्तर-
रदरफोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में धनावेशित कण प्रोटॉन विद्यमान है।
प्रश्न 3.
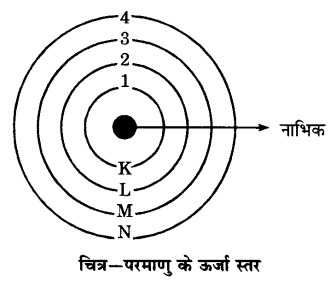
तीन कक्षाओं वाले बोर के परमाण मॉडल का चित्र बनाइये।।
उत्तर-
तीन कक्षाओं वाले बोर के परमाणु का मॉडल चित्र निम्न प्रकार से है। तीन कक्षाएँ क्रमशः K, L तथा M द्वारा दिखाई गई हैं
प्रश्न 4.
क्या अल्फा किरणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से संभव होगा?
उत्तर-
अल्फा किरणों के प्रकीर्णन प्रयोग में सोने की पन्नी को इसलिए चुना गया क्योंकि सोने की परत बहुत पतली अवस्था में प्राप्त हो सकती है अर्थात् 1000 परमाणुओं की मोटाई के बराबर। यदि दूसरी भारी धातु लें तो हम इतनी पतली परत वाली पन्नी प्राप्त नहीं कर सकते अतः अल्फा किरणों का प्रकीर्णन तो इससे भी संभव होगा परन्तु परिणाम इतने स्पष्ट नहीं होंगे जितने सोने की पन्नी से प्राप्त होंगे।
पाठगत प्रश्न (पृष्ठ संख्या – 56)
प्रश्न 1.
परमाणु के तीन अवपरमाणुक कणों के नाम लिखिए।
उत्तर-
परमाणु के तीन प्रमुख कण हैं-इलेक्ट्रॉन, प्रोटॉन, और न्यूट्रॉन।
प्रश्न 2.
होलियम परमाणु का परमाणु द्रव्यमान 4u है तथा उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रान होंगे?
उत्तर-
न्यूट्रॉनों की संख्या = परमाणु द्रव्यमान – प्रोटॉन की संख्या = 4 – 2 = 2
पाठगत प्रश्न (पृष्ठ संख्या – 57)
प्रश्न 1.
कार्बन और सोडियम के परमाणुओं के लिए इलेक्ट्रॉन-वितरण लिखिए।
उत्तर-
प्रश्न 2.
अगर किसी परमाणु का K और L कोश भरा है, तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी ?
उत्तर-
K (पहला कक्ष)
इसमें इलेक्ट्रॉनों की संख्या = 2
L (दूसरा कक्ष)
इसमें इलेक्ट्रॉनों की संख्या = 8
अतः परमाणु में कुल इलेक्ट्रॉन = 2 + 8 = 10.
पाठगत प्रश्न (पृष्ठ संख्या – 58)
प्रश्न 1.
क्लोरीन, सल्फर और मैग्नीशियम की परमाणु संख्या से आप इनकी संयोजकता कैसे प्राप्त करेंगे?
उत्तर-
(i) क्लोरीन परमाणु संख्या = 17
इलेक्ट्रॉनिक विन्यास = 2, 8, 7
क्लोरीन के बाह्यतम कोश को पूर्ण करने के लिए केवल 1 इलेक्ट्रॉन की आवश्यकता होती है। इसलिए इसकी संयोजकता 1 है।
(ii) सल्फर परमाणु क्रमांक = 16
इलेक्ट्रॉनिक विन्यास = 2, 8, 6
क्योंकि इसके बाह्यतम कोश में 6 इलेक्ट्रॉन उपस्थित होते हैं।
अत: इसे पूर्ण रूप से भरने के लिए 2 इलेक्ट्रॉन की आवश्यकता होती है। अतः इसकी संयोजकता 2 है।
(iii) मैग्नीशियम परमाणु क्रमांक = 12
इलेक्ट्रॉनिक विन्यास = 2, 8, 2
क्योंकि इसके बाह्यतम कोश में 2 इलेक्ट्रॉन हैं
अतः इसकी संयोजकता 2 होगी।
पाठगत प्रश्न (पृष्ठ संख्या – 59)
प्रश्न 1.
यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब,
(a) परमाणु की परमाणुक संख्या क्या है ?
(b) परमाणु का क्या आवेश है ?
उत्तर-
(a) परमाणु संख्या = प्रोटॉनों की संख्या = 8
(b) प्रोटॉनों की संख्या = 8
धनात्मक आवेश = 8
इलेक्ट्रॉनों की संख्या = 8
ऋणात्मक आवेश = 8
कुल आवेश = + 8 (- 8) = 0
प्रश्न 2.
पाठ्य-पुस्तक की सारणी 4.1 की सहायता से ऑक्सीजन और सल्फर परमाणुओं की द्रव्यमान संख्या ज्ञात कीजिए।
उत्तर-
(i) ऑक्सीजन की द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या = 8 + 8 = 16 u
(ii) सल्फर की परमाणु द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या = 16 + 16 = 32 u
पाठगत प्रश्न (पृष्ठ संख्या – 60)
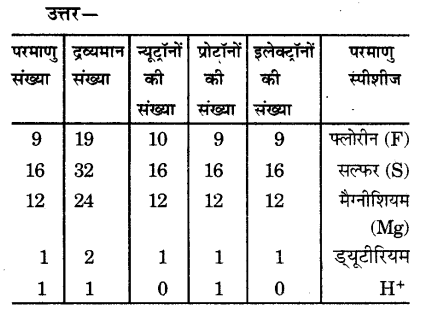
प्रश्न 1.
चिन्ह H, D और T के लिए प्रत्येक में पाए जाने वाले तीन अवपरमाणुक कणों को सारणीबद्ध कीजिए।
प्रश्न 2.
समस्थानिक और समभारिक के किसी एक युग्म का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर-
कार्बन के समस्थानिक हैंऔर
(कार्बन-12)
प्रोटॉनों की संख्या = 8
इलेक्ट्रॉनों की संख्या = 6
न्यूट्रॉन की संख्या = 12 – 6 = 6
इलेक्ट्रॉनिक विन्यास = 2, 4(कार्बन-14)
इलेक्ट्रॉन की संख्या = 6
न्यूट्रॉन की संख्या = 14 – 6 = 8
प्रोटॉन की संख्या = 6
इलेक्ट्रॉनिक विन्यास = 2, 4
समभारिकआर
(ऑर्गन)
इलेक्ट्रॉन की संख्या = 18
प्रोटॉन की संख्या = 18
न्यूट्रॉन की संख्या = 40 – 18 = 22
इलेक्ट्रॉनिक विन्यास = 2, 8, 8, 4(कैल्सियम)
इलेक्ट्रॉन की संख्या = 20
प्रोटॉन की संख्या = 20
न्यूट्रॉन की संख्या = 40 – 20 = 20
इलेक्ट्रॉनिक विन्यास = 2, 8, 8, 2
अभ्यास के प्रश्न (पृष्ठ संख्या 61 – 63)
प्रश्न 1.
इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना कीजिए।
उत्तर-
इलेक्ट्रॉन, प्रोटॉन व न्यूटॉन के गुणों की तुलना-
प्रश्न 2.
जे. जे. टामसन के परमाणु मॉडल की क्या सीमाएँ हैं ?
उत्तर-
जे.जे. टामसन ने परमाणु को एक गोले के रूप में प्रतिपादित किया, जिसमें प्रोटॉनों की उपस्थिति के कारण धनात्मक आवेश होता है और इलेक्ट्रॉन इसके अन्दर धंसे होते हैं। टॉमसन के पास इसे प्रायोगिक रूप में सिद्ध करने का कोई प्रमाण नहीं था और इस मॉडल द्वारा दूसरे वैज्ञानिकों द्वारा किये गये प्रयोगों के परिणामों को भी नहीं समझाया जा सकता है।
प्रश्न 3.
रदरफोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं ?
उत्तर-
रदरफोर्ड के परमाणु मॉडल की कमियाँ-रदरफोर्ड ने प्रस्तावित किया कि इलेक्ट्रॉन धनावेशित नाभिक के चारों ओर घूमते हैं (या चक्कर लगाते हैं)।
चित्र- चक्कर लगाता इलेक्ट्रॉन नाभिक में प्रवेश करता हुआ
अतः नाभिक व घूमने वाले इलेक्ट्रॉनों के मध्य आकर्षण बल इलेक्ट्रॉनों के अपकेन्द्रिय बल से संतुलित हो जाता है। परन्तु जब आवेशित वस्तु वृत्ताकार पथ पर घूमती है तो वह विकिरण उत्सर्जित करती है, जिससे ऊर्जा में हानि होती है। इसके फलस्वरूप इलेक्ट्रॉनों को नाभिक में गिर जाना चाहिए। अगर ऐसा होता तो परमाणु अस्थिर हो जायेगा। परन्तु परमाणु स्थायी है। इन सब तथ्यों की रदरफोर्ड व्याख्या न कर सका और परमाणु की स्थिरता के कारण की व्याख्या भी नहीं कर सका।
प्रश्न 4.
बोर के परमाणु मॉडल की व्याख्या कीजिए।
उत्तर-
बोर का परमाणु मॉडल- रदरफोर्ड के परमाणु मॉडल की त्रुटियों का निवारण करके बोर ने परमाणु का नया मॉडल प्रस्तावित किया। उसकी मुख्य धाराएँ निम्नलिखित हैं|
- इलेक्ट्रॉन परमाणु के नाभिक के चारों ओर निश्चित कक्षाओं में चक्कर लगाते हैं जिन्हें कक्ष कहते हैं।
- एक इलेक्ट्रॉन जब किसी कक्ष में चक्कर लगाता है तो उसमें निश्चित ऊर्जा होती है और ऊर्जा का विकिरण नहीं होता।
- प्रत्येक कक्ष की अपनी निश्चित ऊर्जा होती है। इसीलिए उन्हें ऊर्जा स्तर कहा जाता है।
- इन ऊर्जा स्तरों को K, L, M, N… द्वारा या 1, 2, 3, 4 … द्वारा प्रदर्शित करते हैं।
प्रश्न 5.
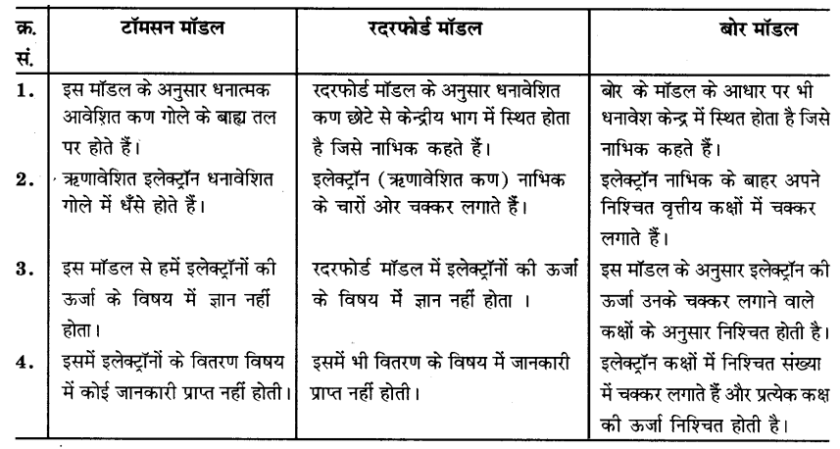
इस अध्याय में दिए सभी परमाणु मॉडलों की तुलना कीजिए।
उत्तर-
इस अध्याय में टॉमसन, रदरफोर्ड व बोर के परमाणु मॉडल दिये गये हैं। इनकी तुलना निम्न प्रकार से कर सकते हैं-
प्रश्न 6.
पहले अठारह तत्त्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के नियमों को लिखिए।
उत्तर-
प्रथम 18 तत्त्वों के इलेक्ट्रॉनिक विन्यास लिखने के लिए प्रयोग किए गए नियम निम्न प्रकार से हैं
1. किसी भी कक्ष में उपस्थित इलेक्ट्रॉन की संख्या एक सूत्र 2n² द्वारा ज्ञात की जाती है, जहाँ n = कक्ष की संख्या या ऊर्जा स्तर की संख्या। अतः अधिकतम इलेक्ट्रॉनों की संख्या
पहले कक्ष (K) में होगी = 2 x 1² = 2
दूसरे कक्ष (L) में होगी = 2 x 2² = 8
तीसरे कक्ष (M) में होगी = 2 x 3² = 18
चौथे कक्ष (N) में होगी = 2 x 4² = 32
2. बाह्यतम कोष में अधिकतम आठ इलेक्ट्रॉन रखे जा सकते हैं।
3. पहले कक्ष में इलेक्ट्रॉनों की संख्या पूर्ण होने पर शेष इलेक्ट्रॉन दूसरे कक्ष में जा सकते हैं अर्थात् कक्ष क्रमानुसार ही भरे जाते हैं।
प्रश्न 7.
सिलिकॉन व ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
उत्तर-
किसी तत्त्व की संयोग करने की क्षमता को उसकी संयोजकता कहते हैं। यह उस परमाणु के बाह्यतम कोश (कक्ष) में उपस्थित इलेक्ट्रॉनों की संख्या से ज्ञात की जाती है।
यदि बाह्यतम कोश में इलेक्ट्रॉनों की संख्या चार या उससे कम हो तो संयोजकता = बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या।
उदाहरण- सिलिकॉन (Si) की परमाणु संख्या 14 है।
अतः इसका इलेक्ट्रॉनिक विन्यास = 2, 8, 4
सिलिकॉन की संयोजकता = 4
यदि बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या चार से अधिक हो तो
संयोजकता = 8 – (बाह्यतम कोश में इलेक्ट्रॉनों की संख्या)
उदाहरण- ऑक्सीजन (O) की परमाणु संख्या 8 है।
इसका इलेक्ट्रॉनिक वितरण = 2, 6
अतः इसकी संयोजकता = 8 – 6 = 2
प्रश्न 8.
उदाहरण सहित व्याख्या कीजिए-परमाणु संख्या, द्रव्यमान संख्या, समस्थानिक और समभारिक। समस्थानिकों के कोई दो उपयोग लिखिए।
उत्तर-
1. परमाणु संख्या – परमाणु के नाभिक में पाए जाने वाले (धनावेशित कण) प्रोटॉनों की संख्या को परमाणु संख्या कहते हैं।
इसे Z द्वारा दर्शाया जाता है।
उदाहरण-
कार्बन की परमाणु संख्या 6 है क्योंकि इसके नाभिक में 6 प्रोटॉन पाए जाते हैं।
ऑक्सीजन की परमाणु संख्या 8 है क्योंकि ऑक्सीजन के परमाणु के नाभिक में 8 प्रोटॉन पाए जाते हैं।
2. द्रव्यमान संख्या – परमाणु के नाभिक में पाए जाने वाले प्रोटॉन व न्यूट्रॉन की कुल संख्या को द्रव्यमान संख्या कहते हैं।
द्रव्यमान संख्या = प्रोटॉन की संख्या + न्यूट्रॉन की संख्या
उदाहरण-
ऑक्सीजन की द्रव्यमान संख्या (परमाणु द्रव्यमान) 16 है क्योंकि ऑक्सीजन के परमाणु के नाभिक में 8 प्रोटॉन व 8 न्यूट्रॉन है।
अतः द्रव्यमान संख्या = 8 + 8 = 16
सोडियम की द्रव्यमान संख्या 23 है क्योंकि सोडियम के नाभिक में 11 प्रोटॉन व 12 न्यूट्रॉन हैं।
अतः द्रव्यमान संख्या = 11 + 12 = 23
समस्थानिक – एक ही तत्त्व के वे परमाणु जिनके परमाणु संख्या समान परन्तु द्रव्यमान संख्या भिन्न-भिन्न हों, समस्थानिक कहलाते हैं।
समस्थानिकों के दो उपयोग-
- यूरेनियम के एक समस्थानिक का उपयोग परमाणु भट्टी में ईंधन के रूप में किया जाता है।
- कैंसर के उपचार में कोबाल्ट के एक समस्थानिक का उपयोग होता है।
- पेंघा रोग के उपचार में आयोडीन के समस्थानिक का उपयोग होता है।
प्रश्न 9.
Na+ के पूरी तरह से भरे हुए K वे L कोश होते हैं- व्याख्या कीजिए।
उत्तर-
Na की परमाणु संख्या = 11
Na+ में उपस्थित इलेक्ट्रॉन की संख्या = 11 – 1 = 10
Na+ का इलेक्ट्रॉनिक विन्यास = K, L = 2, 8
अत: Na+ में K तथा L कोश पूरी तरह भरे होते हैं।
प्रश्न 10.
अगर ब्रोमीन परमाणु दो समस्थानिकों [(49.7%) तथा
(50.3%)] के रूप में हैं, तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान की गणना कीजिए।
प्रश्न 11.
एक तत्त्व X का परमाणु द्रव्यमान 16.2 u है तो इसके किसी एक नमूने में समस्थानिक और
का प्रतिशत क्या होगा?
प्रश्न 12.
यदि तत्त्व का Z = 3 हो तो उस तत्त्व की संयोजकता क्या होगी? उस तत्त्व का नाम भी लिखिए।
उत्तर-
दिया है- Z = 3
इलेक्ट्रॉनिक विन्यास = 2, 1
तत्त्व की संयोजकता = 1
तत्त्व का नाम = लीथियम (Li)
प्रश्न 13.
दो परमाणु स्पीशीज के केन्द्रकों का संघटन नीचे दिया गया है
प्रोटॉन = 6(X) 6(Y)
न्यूट्रॉन = 6(X) 8(Y)
X और Y की द्रव्यमान संख्या ज्ञात कीजिए। इन दोनों स्पीशीज में क्या सम्बन्ध है?
उत्तर-
X की द्रव्यमान संख्या = प्रोटॉन + न्यूट्रॉन = 6 + 6 = 12u
Y की द्रव्यमान संख्या = प्रोटॉन + न्यूट्रॉन = 6 + 8 = 14u
X और Y दोनों में प्रोटॉनों की संख्या समांन है अर्थात् दोनों की परमाणु संख्या समान है। परन्तु उनकी द्रव्यमान संख्या भिन्न है।
अतः दोनों एक ही तत्त्व के समस्थानिक हैं।
प्रश्न 14.
निम्नलिखित कथनों में से सही पर “T” और गलत पर “F” लिखिए
(a) जे. जे. टॉमसन ने यह प्रस्तावित किया था कि परमाणु के केन्द्रक में केवल न्यूक्लीयॉन्स होते हैं।
(b) एक इलेक्ट्रॉन और प्रोटॉन मिलकर न्यूट्रॉन का निर्माण करते हैं इसलिए यह अनावेशित होता है।
(c) इलेक्ट्रॉन का द्रव्यमान प्रोटॉन से लगभग गुना होता है।
(d) आयोडीन के समस्थानिक का इस्तेमाल टिंक्चर आयोडीन बनाने में होता है। इसका उपयोग दवा के रूप में होता है।
उत्तर-
(a) F, (b) F, (c) T, (d) T.
प्रश्न संख्या 15, 16, 17 और 18 में सही के सामने (✓) का चिह्न और गलत के सामने (✗) का चिह्न लगाइए।
प्रश्न 15. रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था
(a) परमाणु केन्द्रक
(b) इलेक्ट्रॉन
(c) प्रोटॉन
(d) न्यूट्रॉन
उत्तर-
(a) ✓
(b) ✗
(c) ✗
(d) ✗
प्रश्न 16.
एक तत्त्वे के समस्थानिक में होते हैं
(a) समान भौतिक गुण
(b) भिन्न रासायनिक गुण
(c) न्यूट्रॉनों की अलग-अलग संख्या
(d) भिन्न परमाणु संख्या
उत्तर-
(a) ✗
(b) ✗
(c) ✓
(d) ✗
प्रश्न 17.
Cl– आयन में संयोजकत्ना-इलेक्ट्रॉनों की संख्या है
(a) 16
(b) 8
(c) 17
(d) 18
उत्तर-
(a) ✗
(b) ✓
(c) ✗
(d) ✗
प्रश्न 18.
सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में कौन-सा है ?
(a) 2, 8
(b) 8, 2, 1
(c) 2, 1, 8
(d) 2, 8, 1
उत्तर-
(a) ✗
(b) ✗
(c) ✗
(d) ✓
प्रश्न 19.
निम्नलिखित सारणी को पूरा कीजिए-
अन्य महत्वपूर्ण प्रश्नोत्तर
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
कैथोड किरणों से उत्पन्न होने वाली दूसरी किरण का नाम बताइये जिसका उपयोग चिकित्सा क्षेत्र में किया जाता है।
उत्तर-
कैथोड किरणों से उत्पन्न होने वाली दूसरी किरण का नाम एक्स-किरणें (X-Rays) है जिसका उपयोग चिकित्सा क्षेत्र में किया जाता है।
प्रश्न 2.
X-किरणें किन्हें कहते हैं अथवा X-किरणों को परिभाषित कीजिए।
उत्तर-
X-किरणें (X-Rays)- जब कैथोड किरणें उच्च गलनांक की किसी धातु जैसे टंगस्टन (W) के लक्ष्य से टकराती हैं तो अत्यधिक ऊर्जा वाली आवेशरहित किरणे प्राप्त होती हैं, जिन्हें x-किरणें कहते हैं।
प्रश्न 3.
कैथोड किरणों के दो गुण लिखिए।
उत्तर-
कैथोड किरणों के दो गुण-
(1) ये किरणें ऋणावेशित होती हैं।
(2) इनमें गतिज ऊर्जा होती है।
प्रश्न 4.
X-किरणों की खोज किसने की थी ?
उत्तर-
X-किरणों की खोज डब्ल्यू. के. रान्टजन (W. K. Rontgen) ने की थी।
प्रश्न 5.
X-किरणें किस प्रकार उत्पन्न होती हैं ?
उत्तर-
कैथोड किरणों के उच्च गलनांक की भारी धातु से टकराने से X-किरणें उत्पन्न होती हैं।
प्रश्न 6.
रान्टजन किरणें किन्हें कहते हैं और क्यों?
उत्तर-
X-किरणों को उसके खोजकर्ता के नाम पर रान्टजन किरणें भी कहते हैं।
प्रश्न 7.
धन किरणें’ किन्हें कहते हैं ? अथवा धन किरणों को परिभाषित कीजिए।
उत्तर-
धन किरणें या ऐनोड किरणें (Positive Rays or Anode Rays)- जब विसर्जन नलिका प्रयोग को छिद्रयुक्त कैथोड से दुहराते हैं तो छिद्रयुक्त कैथोड के पीछे परदे पर एक मन्द दीप्ति दिखाई देती है। यह दीप्ति किन्हीं धनावेशित कणों से बनी किरणों की उपस्थिति के कारण होती है। इन किरणों को धन किरणें या ऐनोड किरणें कहते हैं।
प्रश्न 8.
धन किरणों या ऐनोड किरणों की खोज किसने की थी ?
उत्तर-
धन किरणों या ऐनोड किरणों की खोज ई. गोल्डस्टीन (E. Goldstein) ने की थी।
प्रश्न 9.
ऐनोड किरणों को केनाल किरणें क्यों कहा जाता है ?
उत्तर-
ऐनोड किरणों को केनाल किरणें (Canal Rays) भी कहा जाता है, क्योंकि ये कैथोड के छिद्रों या केनाल में से होकर निकलती हैं।
प्रश्न 10.
धन किरणों को ऐनोड किरणें क्यों कहते हैं?
उत्तर-
धन किरणे ऐनोड से कैथोडं की ओर चलती हैं, इसलिए इन्हें ऐनोंड किरणें कहते हैं।
प्रश्न 11.
कैथोड एवं ऐनोड किरणों का कोई एक गुण लिखिए जिसमें दोनों समानता दशति हैं।
उत्तर-
दोनों में गतिज ऊर्जा होती है जिससे दोनों ही अपने मार्ग में रखे हल्के पहिये को घुमा देती हैं।
प्रश्न 12.
कैथोड किरणों का अध्ययन किसने किया ?
उत्तर-
कैथोड किरणों का अध्ययन सर जे.जे.टॉमसने ने 1897 में किया था।
प्रश्न 13.
कैथोड किरणें कैसे प्राप्त करते हैं ?
उत्तर-
कैथोड किरणों को प्राप्त करना-विसर्जन नलिका में निम्न दाब (लगभग 0.001 मिमी पारे के तल) पर उच्च विभव पर विद्युत प्रवाहित करके कैथोड किरणें प्राप्त करते हैं।
प्रश्न 14.
कैसे सिद्ध होता है कि कैथोड किरणें सीधी रेखा में चलती हैं ?
उत्तर-
यदि कैथोड किरणों के मार्ग में कोई ठोस वस्तु रख दी जाये तो उसकी छाया दिखाई देती है। इससे सिद्ध होता है कि कैथोड किरणें सीधी रेखा में चलती हैं।
प्रश्न 15.
कैसे सिद्ध होता है कि कैथोड किरणें गतिज ऊर्जा युक्त कणों से बनी हैं ?
उत्तर-
यदि कैथोड किरणों के मार्ग में किसी धातु की हल्की चकरी रख दी जाये तो चकरी घूमने लगती है। इससे सिद्ध होता है कि कैथोड किरणें ऐसे कणों से बनी हैं जिनमें गतिज ऊजी होती है।
प्रश्न 16.
कैसे सिद्ध होता है कि कैथोड किरणें ऋणावेशित कण हैं ?
उत्तर-
कैथोड किरणें जब विद्युत क्षेत्र से होकर गुजरती हैं तो धन प्लेट की ओर आकर्षित होती हैं। इससे सिद्ध होता है कि कैथोड किरणें ऋणावेशित कणों से बनी होती हैं।
प्रश्न 17.
प्रोटॉन के आवेश तथा द्रव्यमान का अनुपात (e/m) कितना होता है ?
उत्तर-प्रोटॉन के आवेश तथा द्रव्यमान का अनुपात (e/m) का मान 9.58 x 104 कूलॉम प्रति ग्राम होता है।
प्रश्न 18.
परमाणु का पहला मॉडल किस वैज्ञानिक ने दिया ?
उत्तर-
परमाणु को पहला मॉडल जे. जे. टॉमसन (J. J. Thomson) ने दिया।
प्रश्न 19.
रदरफोर्ड के परमाणु मॉडल के दो दोष कौन-कौन से थे ?
अथवा
रदरफोर्ड के परमाणु मॉडल के महत्त्वपूर्ण दोष क्या
उत्तर-
रदरफोर्ड के परमाणु मॉडल के दोष- रदरफोर्ड के परमाणु मॉडल के दो दोष निम्नलिखित हैं
(1) परमाणु के स्थायित्व की व्याख्या न कर पाना ।
(2) परमाणु के विभिन्न स्पेक्ट्रम की व्याख्या न करे पाना।
प्रश्न 20.
नील बोर के परमाणु मॉडल के अनुसार जब इलेक्ट्रॉन एक ही ऊर्जा स्तर में घूमता है तब वह ऊर्जा का उत्सर्जन करता है या अवशोषण या इलेक्ट्रॉन की ऊर्जा में कोई परिवर्तन नहीं होता, उत्तर दीजिए।
उत्तर-
इलेक्ट्रॉन की ऊर्जा में कोई परिवर्तन नहीं होता।
प्रश्न 21.
कक्षा या ऊर्जा स्तर किसे कहते हैं ?
उत्तर-
कक्षा या ऊर्जा स्तर (Shells or Energy Levels)- “नाभिक के चारों ओर निश्चित ऊर्जा वाले वे पथ जिनमें इलेक्ट्रॉन घूमते रहते हैं: कक्षा, कोश या ऊर्जा-स्तर कहलाते हैं।”
प्रश्न 22.
बोर के परमाणु मॉडल में (K, L, M, N) कक्षाओं में से नाभिक की निकटतम कक्षा कौन-सी है ?
उत्तर-
बोर के परमाणु मॉडल में K कक्षा नाभिक की निकटतम कक्षा है।
प्रश्न 23.
किसी कक्षा में इलेक्ट्रॉन की अधिकतम संख्या कितनी हो सकती है?
उत्तर-
किसी कक्षा में इलेक्ट्रॉन की अधिकतम संख्या 2n² हो सकती है जहाँ कक्षा का क्रमांक है।
प्रश्न 24.
सबसे बाहरी कक्षा (कोश) में और उसके अन्दर वाली कक्षा में अधिकतम कितने इलेक्ट्रॉन हो सकते हैं ?
उत्तर-
सबसे बाहरी कक्षा (कोश) में अधिकतम 8 इलेक्ट्रॉन तथा उसके अन्दर वाली कक्षा (कोश) में अधिकतम 18 इलेक्ट्रॉन हो सकते हैं।
प्रश्न 25.
संयोजी कोश को परिभाषित कीजिए।
उत्तर-
संयोजी कोश-किसी परमाणु के बाह्यतम कोश को संयोजी कोश कहते हैं।
लघु उत्तरीय प्रश्न
प्रश्न 1.
टॉमसन के परमाणु मॉडल के दो मुख्य अभिगृहीतियाँ बताइये।
उत्तर-
(i) परमाणु धन आवेशित गीले को बना होता है और इलेक्ट्रॉन उसमें फँसे होते हैं।
(ii) ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं।
प्रश्न 2.
समस्थानिक तथा समभारिक में दो अन्तर लिखिए।
उत्तर-
समस्थानिक (Isotopes)-
(1) परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न होती है।
(2) प्रोटॉनों की संख्या समान होती है।
समभारिक (Isobars)-
(1) परमाणु संख्या अलग-अलग होती है लेकिन द्रव्यमान संख्या समान होती है।
(2) प्रोटॉनों की संख्या भिन्न होती है।
प्रश्न 3.
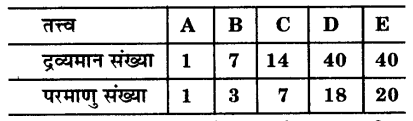
निम्नलिखित सारणी में कुछ तत्त्वों की द्रव्यमान संख्या तथा परमाणु संख्या दी गई है :
(a) उपर्युक्त सारणी से एक जोड़ा समभारिक चुनिए।
(b) उपर्युक्त सारणी में दिये गए तत्त्व ‘B’ की संयोजकता क्या होगी ?
उत्तर-
(a) D तथा E समभारिक हैं क्योंकि इनकी परमाणु संख्याएँ (40) परन्तु भिन्न-भिन्न द्रव्यमान संख्याएँ क्रमशः 18 तथा 20 हैं।
(b) B का इलेक्ट्रॉनिक विन्यास = 2, 5
अत: B की संयोजकता = 3, 5
प्रश्न 4.
एक तत्त्व ‘X’ का इलेक्ट्रॉनिक विन्यास 2, 8, 2 है।
(a) इलेक्ट्रॉन की संख्या ज्ञात कीजिए जो तत्व x में उपस्थित है।
(b) इसकी परमाणु संख्या लिखिए।
(c) यह तत्त्व ‘X’ एक धातु है या अधातु?
(d) तत्त्व X की संयोजकता ज्ञात कीजिए।
उत्तर-
(a) X में उपस्थित इलेक्ट्रॉनों की संख्या = 2 + 8 + 2 = 12
(b) X की परमाणु संख्या = 12
(c) तत्त्व X एक धातु है।
(d) X की संयोजकता = 2
प्रश्न 5.
इलेक्ट्रॉन, प्रोटॉन एवं न्यूट्रॉन के गुणों की तुलना कीजिए तथा इनकी परमाणु में स्थिति एवं इनके खोजकर्ता का नाम लिखिए।
अथवा
इलेक्ट्रॉन, प्रोटॉन एवं न्यूट्रॉन की आवेश एवं द्रव्यमान के तुलना कीजिए। इन कणों के खोजकर्ता का नाम एवं परमाणु क्रमांक में इनका स्थान लिखिए।
उत्तर-
इलेक्ट्रॉन, प्रोटॉन एवं न्यूट्रॉन के गुणों की तुलना-
प्रश्न 6.
रदरफोर्ड के प्रयोग का चित्र बनाइये तथा इसके निष्कर्ष लिखिये।
उत्तर-
रदरफोर्ड के प्रयोग का चित्र-
रदरफोर्ड के प्रयोग के निष्कर्ष
(1) प्रयोग में परमाणु के केन्द्रीय भाग से टकराकर कुछ α-कण वापस लौट आते हैं इससे निष्कर्ष निकलता है कि परमाणु का केन्द्रक ठोस, अभेद्य तथा प्रतिकर्षी है।
(2) अधिकांश α-कण स्वर्ण पत्र में बिना छेद किये सरल रेखा से बाहर निकल जाते हैं इससे निष्कर्ष निकलता है कि परमाणु खोखला है।
(3) कुछ α-कण विचलित हो जाते हैं इससे निष्कर्ष निकलता है कि परमाणु में ऋणावेशित कण हैं।
प्रश्न 7.
(a) नीचे दी गई स्पीशीज में किसमें 18 इलेक्ट्रॉन हैं ?
(a) Ca2+, K+, Cl, Ar
(b) किसी तत्त्व के सभी समस्थानिकों के रासायनिक गुण एकसमान होते हैं। कारण लिखिए।
उत्तर-
(a) Ca2+, K+, Cl, Ar
(b) समस्थानिकों में इलेक्ट्रॉनों की संख्या समान है, तब उनका इलेक्ट्रॉन विन्यास तथा संयोजकता इलेक्ट्रॉन की संख्या भी समान होगी।
अतः समस्थानिकों के रासायनिक गुण एकसमान होते हैं।
प्रश्न 8.
नील बोर द्वारा अपने परमाणु मॉडल में शामिल नई संकल्पनाएँ बताइए। इस मॉडल को दिखाने के लिए एक रेखाचित्र खींचिए।
उत्तर-
बोर के मॉडल में शामिल नई संकल्पनाएँ हैं
(i) निश्चित ऊर्जायुक्त कुछ खास कक्षाएँ ही स्वीकार्य हैं।
(ii) जब तक कोई इलेक्ट्रॉन कण ऊर्जा स्तर में गतिशील है, इसमें ऊर्जा की हानि या लाभ नहीं होता।
(iii) जब इलेक्ट्रॉन ऊर्जा ग्रहण करते हैं तो उच्च ऊर्जा स्तर में पहुँच जाते हैं। जब ऊर्जा की हानि होती है तो निम्न ऊर्जा स्तर पर आ जाते हैं। इसे चित्र द्वारा दिखाया गया है।
प्रश्न 9.
एक तत्त्व के रूप में निरूपित होता है। ज्ञात कीजिए-
(a) तत्त्व x में इलेक्ट्रॉनों की संख्या,
(b) तत्त्व x की द्रव्यमान संख्या,
(c) तत्त्व x में न्यूट्रॉनों की संख्या।।
उत्तर-
(a) तत्त्व x में इलेक्ट्रॉनों की संख्या = 8
(b) तत्त्व x की द्रव्यमान संख्या = 16
(c) तत्त्व x में न्यूट्रॉनों की संख्या = 16 – 8 = 8
प्रश्न 10.
(a) किसी परमाणु के तीन अवपरमाणुक कणों के नाम लिखिए।
(b) किसी तत्त्व में परमाणु की L कक्षा में पाँच इलेक्ट्रॉन हैं-
(i) तत्त्व की परमाणु संख्या क्या है ?
(ii) इसकी संयोजकता व्यक्त कीजिए।
(iii) तत्त्व को पहचानिए तथा इसका नाम लिखिए।
उत्तर-
(a) किसी परमाणु के तीन अवपरमाणुक कणों के नाम हैं : इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन।
(b) K कोश में इलेक्ट्रॉनों की संख्या = 2
L कोश में इलेक्ट्रॉनों की संख्या = 5
(i) तत्त्व की परमाणु संख्या 2 + 5 = 7
(ii) तत्त्व की संयोजकता।
(iii) तत्त्व नाइट्रोजन (N) है।
प्रश्न 11.
(a) हीलियम तथा बेरीलियमें दोनों में ही संयोजकता कक्षा में 2 इलेक्ट्रॉन होते हैं। हीलियम एक अक्रिय गैस है जबकि बेरीलियम एक धातु है। पुष्टि कीजिए।
(b) हाइड्रोजन का अस्तित्व तीन समस्थानिक रूपों में होता है। हाइड्रोजन के समस्थानिक रासायनिक रूप से समान क्यों होते हैं ?
उत्तर-
(a) हीलियम के बाह्यतम कक्ष में इलेक्ट्रॉनों की संख्या उसकी अधिकतम संख्या के बराबर है अतः हीलियम एक अक्रिय गैस है। बेरीलियम तत्त्व धातु है क्योंकि यह इलेक्ट्रॉन त्याग करके धनात्मक आयन बनाता है।
(b) समस्थानिकों में इलेक्ट्रॉनों की संख्या समान है। अतः उनका इलेक्ट्रॉन विन्यास और संयोजकता इलेक्ट्रॉन की संख्या भी समान होती है। अत: हाइड्रोजन के समस्थानिक रासायनिक रूप से समान होते हैं।
प्रश्न 12.
समस्थानिक और समभारिक क्या होते हैं ? क्लोरीन के दो समस्थानिक कौन-कौन से हैं ? क्लोरीन के प्राकृतिक नमूने में इनका क्या अनुपात होता है ? क्लोरीन परमाणु का औसत परमाणु द्रव्यमान परिकलित कीजिए।
उत्तर-
समस्थानिक- एक ही तत्त्व के परमाणु जिनकी परमाणु संख्या समान तथा द्रव्यमान भिन्न होता है, समस्थानिक कहलाते हैं।
समभारिक- वे परमाणु जिनकी द्रव्यमान संख्या समान होती है परन्तु परमाणु क्रमांक भिन्न होते हैं, समभारिक कहलाते हैं।
प्रश्न 13.
परमाणु नाभिक के आवश्यक गुणधर्मों की व्याख्या कीजिए।
उत्तर-
परमाणु नाभिक के गुणधर्म :
(i) परमाणु नाभिक धनावेश युक्त होता है।
(ii) परमाणु का सम्पूर्ण द्रव्यमान उसके नाभिक में ही स्थित होता है।
(iii) परमाणु नाभिक की त्रिज्या 10-13 से 10-12 cm होती है, जबकि सम्पूर्ण परमाणु की त्रिज्या लगभग 10-8 cm होती है।
अत: परमाणु का अधिकांश भाग रिक्त होता है।
प्रश्न 14.
टॉमसन परमाणु मॉडल, रदरफोर्ड परमाणु मॉडल तथा बोर परमाणु मॉडलों की तुलना कीजिए।
उत्तर-
टॉमसन परमाणु मॉडल – टॉमसन ने तरबूज के समान परमाणु मॉडल प्रस्तावित किया जिसमें परमाणु का धनावेश तरबूज के खाने वाले भाग की भाँति फैला हुआ है, जबकि इलेक्ट्रॉन (ऋणावेश) धनावेशित गोले में तरबूज के बीज की भाँति फँसे हैं। ऋणावेश तथा धनावेश परिमाण में समान होते हैं। इसलिए परमाणु विद्युतीय उदासीन होता है।
रदरफोर्ड परमाणु मॉडल – इसके अनुसार, परमाणु में धनावेशित केन्द्र, जिसे नाभिक कहते हैं, होता है और इलेक्ट्रॉन स्थिर कक्षा में चक्कर लगाते हैं। नाभिक का आकार, परमाणु के आकार की तुलना में अत्यन्त कम या उपेक्षणीय होता है।
बोर परमाणु मॉडल – बोर परमाणु मॉडल के अनुसार इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉनों की विविक्त कक्षा कहते हैं। जब इलेक्ट्रॉन इन विविक्त कक्षाओं में चक्कर लगाते हैं तो उनकी ऊर्जा का विकिरण नहीं होता।
प्रश्न 15.
सिलिकॉन और ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
उत्तर-
परमाणु के अन्तिम कोश (बाह्यतम कोश) में विद्यमान इलेक्ट्रॉन, संयोजी इलेक्ट्रॉन कहलाते हैं। किसी परमाणु द्वारा स्थायित्व (अष्टक) प्राप्त करने के लिए, त्यागे गए या प्राप्त या साझा किए गए इलेक्ट्रॉनों की संख्या, उसकी संयोजकता कहलाती है। परमाणु द्वारा अष्टक पूरा करने की क्रिया में संयोजी इलेक्ट्रॉनों का ही स्थानान्तरण या साझा होता है अर्थात संयोजी इलेक्ट्रॉन ही परमाणु की संयोजकता निर्धारित करते हैं। उदाहरणार्थ-सिलिकॉन का परमाणु क्रमांक 14 है। इसका इलेक्ट्रॉनिक विन्यास 2, 8, 4 होगा। इसमें 4 संयोजी इलेक्ट्रॉन उपस्थित हैं अर्थात् इसकी संयोजकता 4 है।
ऑक्सीजन का परमाणु क्रमांक 8 है। इसका इलेक्ट्रॉनिक विन्यास 2, 6 होगा। इसमें 6 संयोजी इलेक्ट्रॉन उपस्थित हैं। ऑक्सीजन परमाणु की प्रवृत्ति दो इलेक्ट्रॉन ग्रहण करके अष्टक प्रदान करने की होती है। अतः इसकी संयोजकता 2 है।
प्रश्न 16.
Na+, K+, Al3-, O2- और F– में कौन-से समइलेक्ट्रॉनी हैं ?
उत्तर-
समइलेक्ट्रॉनी स्पीशीज में इलेक्ट्रॉन की संख्या समान होती है।
उपर्युक्त सारणी से स्पष्ट है कि Na+, K+, Al3-, O2- और F– में 10-10 इलेक्ट्रॉन हैं। अतः ये समइलेक्ट्रॉनी हैं।
प्रश्न 17.
रदरफोर्ड का परमाणु मॉडल क्या है?
उत्तर-
रदरफोर्ड का परमाणु मॉडल (Atomic Model of Rutherford) – रदरफोर्ड ने अपने α-कणों के प्रकीर्णन के प्रयोग द्वारा प्राप्त निष्कर्षों के आधार पर परमाणु का एक मॉडल प्रस्तुत किया जो निम्न प्रकार है
1. परमाणु का अधिकांश द्रव्यमान इसके केन्द्र में निहित है अतः परमाणु के केन्द्रीय भाग में प्रोटॉन एवं न्यूट्रॉन विद्यमान हैं। ये कण न्यूक्लिऑन कहलाते हैं। परमाणु के इस सूक्ष्म केन्द्र को नाभिक या केन्द्रक कहते हैं।
2. केन्द्रक के चारों ओर का अधिकांश भाग रिक्त होता है।
3. परमाणु के केन्द्रक के चारों ओर इलेक्ट्रॉन गतिशील होते हैं।
4.नाभिक का आकार परमाणु के आकार की तुलना में बहुत छोटा होता है।
5.चूँकि परमाणु उदासीन होता है अतः परमाणु में उपस्थित प्रोटॉन एवं इलेक्ट्रॉन की संख्या बराबर होती है।
प्रश्न 18.
रदरफोर्ड के परमाणु मॉडल के महत्त्वपूर्ण दोषों की व्याख्या कीजिए।
उत्तर-
रदरफोर्ड के परमाणु मॉडल के महत्त्वपूर्ण दोषों की व्याख्या (Explanation of Defects of Rutherford’s Atomic Model)-
- परमाणु के स्थायित्व की व्याख्या न कर पाना – रदरफोर्ड के परमाणु मॉडल का पहला दोष यह है कि यह परमाणु के स्थायित्व की व्याख्या नहीं करता है। मैक्सवैल के अनुसार, कोई भी आवेशित कण गतिमान होने पर निरन्तर विद्युत चुम्बकीय तरंगों को विकरित करेगा, जिसमें उसकी ऊर्जा में लगातार कमी होते रहने से उसे अपनी राह (कक्षा) घटानी पड़ेगी और ऐसा करते हुए अन्त में इलेक्ट्रॉन नाभिक में गिरकर नष्ट हो जायेगा परन्तु वास्तव में ऐसा घटित नहीं होता।
- परमाणु में विविक्त स्पेक्ट्रम की व्याख्या न कर पाना – रदरफोर्ड के परमाणु मॉडल का दूसरा प्रमुख दोष यह है कि यह परमाणु के विविक्त स्पेक्ट्रम की व्याख्या भी नहीं कर पाता। रदरफोर्ड के अनुसार इलेक्ट्रॉन की कक्षा की त्रिज्या निरन्तर बदलती रहने के कारण सतत् स्पेक्ट्रम बनना चाहिए परन्तु रैखिक स्पेक्ट्रम प्राप्त होता है।
दीर्घ उत्तरीय प्रश्नप्रश्न
प्रश्न 1.
बोर का परमाणु मॉडल समझाइये।
उत्तर-
बोर का परमाणु मॉडल-नील्स बोर ने क्वाण्टम सिद्धान्त के आधार पर परमाणु संरचना का सरल मॉडल प्रस्तुत किया। इस मॉडल की प्रमुख अभिधारणाएँ निम्नलिखित हैं
- परमाणु के केन्द्र में नाभिक होता है, जिसमें धनावेशित कण (प्रोटॉन) उपस्थित होता है।
- इलेक्ट्रॉन नाभिक के चारों ओर निश्चित ऊर्जा वाले पथ में घूमते हैं। ये निश्चित ऊर्जा वाले पथ कक्षा, कोश या ऊर्जा-स्तर कहलाते हैं।
- कक्षाओं के क्रम को (n) द्वारा व्यक्त किया जाता है जहाँ n = 1, 2, 3, 4….. हैं जो क्रमशः K, L, M, N…. आदि से व्यक्त किये जा सकते हैं।
- n के बढ़ते मान के साथ ये कक्षाएँ नाभिक से दूर होती जाती हैं और उनकी ऊर्जा क्रमशः बढ़ती जाती है। कक्षा k की ऊर्जा सबसे कम होती है। तथा यह नाभिक के निकटतम होती है।
- बोर के अनुसार यदि कोई इलेक्ट्रॉन एक ही ऊर्जा स्तर या कक्षा में घूमता रहे तो इस इलेक्ट्रॉन की ऊर्जा में कोई परिवर्तन नहीं होता है।
- इलेक्ट्रॉन जब बाहर से ऊर्जा ग्रहण करता है तो उत्तेजित होकर निकटतम उच्च ऊर्जा स्तर में चला जाता है और जब ये ऊर्जा का उत्सर्जन करता है तब निकटतम निम्न ऊर्जा के स्तर में चला जाता है।
प्रश्न 2.
इलेक्ट्रॉन वितरण की बोर-बरी योजना क्या है ? इसके अनुसार इलेक्ट्रॉनों की व्यवस्था लिखिए।
उत्तर-
इलेक्ट्रॉनवितरणकबर-बरीयोजना – इलेक्ट्रॉन वितरण के लिए बोर-बरी ने निम्न योजना प्रस्तुत की जिसे बोर-बरी की योजना कहते हैं। इसके प्रमुख बिन्दु निम्नलिखित हैं
(i) परमाणु की किसी भी कक्षा में इलेक्ट्रॉनों की | अधिकतम संख्या 2n² होती है, जहाँ n कक्षा की क्रम संख्या है जो नाभिक से बाहर की ओर गिनी जाती है। इस तरह इलेक्ट्रॉनों की अधिकतम संख्या पहली कक्षा में 2, दूसरी में 8, तीसरी में 18, चौथी में 32 एवं पाँचवीं में 50 होती है।
(ii) सबसे बाहर वाली कक्षा में 8 एवं उसके अन्दर वाली कक्षा में 18 से अधिक इलेक्ट्रॉन कभी नहीं हो सकते।
(iii) किसी कक्षा में 8 इलेक्ट्रॉन होने पर नई कक्षा प्रारम्भ हो जाती है चाहे उसकी अधिकतम सीमा कुछ भी हो।
(iv) सबसे बाहर की कक्षा में 2 से अधिक और उसके अन्दर वाली में 8 से अधिक इलेक्ट्रॉन तब तक नहीं होते जब तक अन्य अन्दर की कक्षाएँ 2n² से पूर्ण न हो जायें।
प्रश्न 3.
रिक्त स्थान भरिए-(इलेक्ट्रॉन विन्यास पूर्ण कीजिए)
प्रश्न 4.
क्लोरीन तत्त्व () के उदाहरण से उसकी परमाणु संरचना का मॉडल बनाइये।
उत्तर-
क्लोरीन परमाणु संरचना का मॉडल-
चित्र- क्लोरीन की परमाणु संरचना
क्लोरीन का परमाणु क्रमांक Z = 17
क्लोरीन की द्रव्यमान संख्या A = 35
प्रोटॉन की संख्या p = Z = 17
न्यूट्रॉन की संख्या n = A – Z = 35 – 17 = 18
इलेक्ट्रॉन की संख्या e = p = 17
इलेक्ट्रॉन का वितरण e = 17 = 2, 8, 7
प्रश्न 5.
(आर्गन तत्व) की परमाणु संरचना बनाइये।
उत्तर-
(आर्गन तत्व) की परमाणु संरचना
चित्र- आर्गन की परमाणु संरचना
आर्गन को परमाणु क्रमांक Z = 18
आर्गन की द्रव्यमान संख्या A = 40
प्रोटॉन की संख्या p = 18
न्यूट्रॉन की संख्या n = A – Z = 40 – 18 = 22
इलेक्ट्रॉन की संख्या e = p = 18
इलेक्ट्रॉन का वितरण e = 18 = 2, 8, 8
प्रश्न 6.
दो तत्त्वों A और B के परमाणुओं के अवपरमाणुक कण नीचे दिए गए हैं। उसका अध्ययन कीजिए तथा निम्न प्रश्नों के उत्तर दीजिए। अपने उत्तर की सत्यता सिद्ध कीजिए।
(i) दोनों में से किसके परमाणु का आकार बड़ा है?
(ii) दोनों में से किसका नाभिक प्रबल है?
(iii) तत्त्व A तथा B की प्रकृति की व्याख्या कीजिए।
उत्तर-
(i) B के परमाणु का आकार बड़ा है क्योंकि B में तीन कोश होते हैं जबकि A में एक कोश होता है।
(ii) B का नाभिक प्रबल है क्योंकि A की द्रव्यमान संख्या 2 + 2 = 4 है जबकि B की द्रव्यमान संख्या 11 + 12 = 23 है।
(iii) A अधातु है जबकि B धातु है। A गैस है तथा B के बाह्यतम कोश में एक इलेक्ट्रॉन है जिसका यह आसानी से त्याग कर सकता है।
प्रश्न 7.
(a) रदरफोर्ड के अल्फा कण प्रकीर्णन प्रयोग में निम्न निष्कर्ष व्युत्पन्न करने के लिए प्रायोगिक प्रमाण दीजिए।
(i) परमाणु के भीतर का अधिकतर भाग खाली होता है।
(ii) परमाणु का केन्द्र धनावेशित होता है।
(b) एक तत्त्व की द्रव्यमान संख्या 32 तथा परमाणु संख्या 16 है, ज्ञात कीजिए :
(i) तत्त्व के परमाणु में न्यूट्रॉनों की संख्या।
(ii) परमाणु के बाह्यतम कोश में इलेक्ट्रॉनों की संख्या ।
(c) रदरफोर्ड के परमाण्वीय मॉडल के आधार पर नाभिक में कौन-सा अवपरमाणुक कण विद्यमान होता है ?
उत्तर-
(a) (i) परमाणु के भीतर का अधिकतर भाग खाली होता है क्योंकि अधिकतर अल्फा कण बिना विक्षेपित हुए सोने की पन्नी को पार कर सीधे निकल गये।
(ii) कुछ α-कण अपने मूल पथ से थोड़ा विक्षेपित हो जाते हैं इससे सिद्ध होता है कि परमाणु का केन्द्र धनावेशित भाग है।
(b) तत्त्व की द्रव्यमान संख्या = 32
तत्त्व की परमाणु संख्या = 16
प्रोटॉनों की संख्या = परमाणु संख्या = 16
न्यूट्रॉनों की संख्या = द्रव्यमान संख्या – प्रोटॉनों की संख्या = 32 – 16 = 16
(ii) तत्त्व का इलेक्ट्रॉन विन्यास = 2, 8, 6
परमाणु के बाह्यतम कोश में इलेक्ट्रॉनों की संख्या = 6
(c) प्रोटॉन।
प्रश्न 8.
(a) उस अवपरमाणुक कण का नाम लिखिए जिसकी खोज जे. चैडविक ने की थी। इस कण पर कौन-सा आवेश होता है ? यह कण परमाणु के कौन-से भाग में स्थित होता है ?
(b) रदरफोर्ड के परमाणु मॉडल के प्रयोग के तीन चरणों की सूची बनाइए।
(c) एक उदाहरण देते हुए समभारिक परमाणु की परिभाषा लिखिए।
(d) यह निष्कर्ष किस वैज्ञानिक ने निकाला था कि परमाणु की अपेक्षा नाभिक का साइज बहुत छोटा होता है।
उत्तर-
(a) जे. चैडविक ने न्यूट्रॉन की खोज की थी। न्यूट्रॉन अनावेशित होता है। यह कण परमाणु के नाभिक में होता है।
(b) (i) रदरफोर्ड ने रेडियोऐक्टिव तत्त्व रेडियम को लैड के बॉक्स के भीतर रखकर प्राप्त अल्फा कणों को एक बारीक स्लिट से गुजारकर इन्हें पुंज के रूप में प्राप्त किया।
(ii) इस पुंज को उन्होंने एक भारी धातु, जैसे-गोल्ड के अत्यन्त पतली पन्नी पर डाला।
(iii) इससे ये अल्फा कण प्रकीर्णित हो गए तथा बहुत-से अल्फा कण पन्नी से पार होकर पीछे लगे जिंक सल्फाइड के मध्य जाकर टकरा गए।
(c) समभारिक – समभारिक, विभिन्न परमाणु संख्याओं परन्तु समान द्रव्यमान संख्या वाले विभिन्न तत्त्वों के परमाणु हैं। समभारिकों में, उनके नाभिकों में प्रोटॉनों की भिन्न संख्या होती है परन्तु उनमें न्यूक्लिआनो (प्रोटानों + न्यूट्रॉनों) की संख्या समान होती है। समभारिकों के उदाहरण आर्गन और कैल्सियम
है।
(d) रदरफोर्ड ने निष्कर्ष निकाला था कि परमाणु की अपेक्षा नाभिक का साइज बहुत छोटा होता है।
प्रश्न 9.
परमाणु क्रमांक 1 से 18 तक के तत्त्वों के परमाणुओं का इलेक्ट्रॉन-विन्यास दीजिए।
उत्तर-
परमाणु क्रमांक 1 से 18 तक के तत्त्वों का इलेक्ट्रॉन विन्यास
प्रश्न 10.
संयोजकता इलेक्ट्रॉन का महत्व लिखिए व तत्त्व की संयोजकता निर्धारण में इसकी भूमिका बताइए।
उत्तर-
संयोजकता – किसी तत्त्व के परमाणु द्वारा दिए जाने, लिए जाने या साझेदारी किए जाने वाले इलेक्ट्रॉन की संख्या, उस तत्त्व को संयोजकता कहलाती है।
हम जानते हैं कि किसी रासायनिक अभिक्रिया में केवल बाह्यतम कक्ष में उपस्थित इलेक्ट्रॉन या संयोजकता इलेक्ट्रॉन ही भाग लेते हैं।
अत: संयोजकता निर्धारण में संयोजकता इलेक्ट्रॉन ही महत्वपूर्ण होते हैं। यदि किसी तत्त्व के परमाणु के संयोजकता इलेक्ट्रॉन 1, 2 या 3 हैं तो उसकी संयोजकता क्रमशः 1, 2 या 3 होगी। यदि तत्त्व के बाह्यतम कक्ष में 4 से 8 इलेक्ट्रॉन हैं तो उसकी संयोजकता (संयोजकता इलेक्ट्रॉन–8) होगी।
उदाहरणार्थ – क्लोरीन या फ्लोरीन के बाह्यतम कक्ष में 7 इलेक्ट्रॉन हैं, तब उनकी संयोजकता 7 – 8 = -1 होगी।
अतः क्लोरीन या फ्लोरीन के आयन को Cl– या F– से प्रदर्शित करेंगे।
अभ्यास प्रश्न
बहुविकल्पीय प्रश्न
1. चैडविक ने खोज की थी
(a) इलेक्ट्रॉन की
(b) प्रोटॉन की
(c) न्यूट्रॉन की
(d) रेडियम की।
2. परमाणु के केन्द्रक में होते हैं
(a) इलेक्ट्रॉन
(b) प्रोटॉन
(c) न्यूट्रॉन
(d) प्रोटॉन तथा न्यूट्रॉन !
3. प्रोटॉन की खोज का श्रेय था
(a) चैडविक को
(b) गोल्डस्टीन को
(c) जे. जे. टॉमसन को
(d) रदरफोर्ड को।
4. X-किरणों की खोज की थी
(a) राण्टजन ने
(b) चैडविक ने
(c) मैडम क्यूरी ने
(d) गोल्डस्टीन ने।
5. समान परमाणु क्रमांक एवं भिन्न परमाणु भार वाले परमाणु कहलाते हैं
(a) समस्थानिक
(b) समभारिक
(c) समन्यूट्रानिक
(d) उपर्युक्त में से कोई नहीं।
6. निम्न किरणों में से सबसे अधिक बेधन क्षमता किसमें होती है?
(a) α-किरणे
(b) X-किरणें
(c) γ-किरणे
(d) कैथोड किरणें
7. सोने की पन्नी द्वारा अल्फा कण प्रकीर्णन का प्रयोग किया
(a) टॉमसन ने
(b) रदरफोर्ड ने
(c) बोर ने
(d) उपरोक्त सभी ने।
8. परमाणु धन आवेश का गोला है, बताया
(a) टॉमसन ने
(b) रदरफोर्ड ने
(c) बोर ने
(d) उपरोक्त सभी ने।
9. इलेक्ट्रॉन कुछ निश्चित कक्षाओं में चक्कर लगाते हैं, प्रतिपादित किया
(a) टॉमसन ने
(b) रदरफोर्ड ने
(c) बोर ने
(d) उपरोक्त सभी ने।
10. अवपरमाणुक कण है
(a) इलेक्ट्रॉन
(b) प्रोटॉन
(c) न्यूट्रॉन
(d) ये सभी।
11. दूसरे कक्ष में इलेक्ट्रॉन की अधिकतम संख्या है
(a) 2
(b) 4
(c) 18
(d) 8
12. डाल्टन के परमाणु सिद्धान्त की कमी थी
(a) उसने परमाणु को अविभाज्य बताया
(b) वह एक ही प्रकार के परमाणुओं से बने विभिन्न पदार्थों के अलग-अलग गुणों की व्याख्या न कर सका।
(c) क्यों कुछ कार्बनिक यौगिकों को संश्लेषण सम्भव नहीं है, स्पष्ट नहीं हो सका।
(d) उपर्युक्त सभी।
13. प्रोटियम में नहीं होता
(a) प्रोटॉन
(b) इलेक्ट्रॉन
(c) न्यूटॉन
(d) ये सभी।
14. दो न्यूट्रॉन होते हैं
(a) ड्यूटीरियम में
(b) ट्राइटियम में
(c) प्रोटियम में
(d) उपर्युक्त सभी में।
15. Ca व Ar के परमाणु हैं
(a) समस्थानिक
(b) समभारिक
(c) समावयव
(d) ये सभी।
16. फ्लोरीन की परमाणु संख्या 9 है, F– में इलेक्ट्रॉन की कुल संख्या होगी
(a) 9
(b) 8
(c) 10
(d) 19
17. किसी तत्त्व के समस्थानिकों में
(a) प्रोटॉन की संख्या भिन्न होती है।
(b) इलेक्ट्रॉन की संख्या भिन्न होती है।
(c) न्यूट्रॉन की संख्या भिन्न होती है।
(d) न्यूट्रॉन की संख्या समान होती है।
18. जब एक न्यूट्रॉन विघटित होता है तो ……… उत्पन्न होता है।
(a) एक प्रोटॉन
(b) एक इलेक्ट्रॉन
(c) एक न्यूट्रॉन व एक इलेक्ट्रॉन
(d) एक प्रोटॉन व एक इलेक्ट्रॉन
19. रेडियो आइसोटोप डेटिंग में ……. करते हैं।
(a) 12C परमाणु की
(b) 10C परमाणु की
(c) 14C परमाणु की
(d) 3C परमाणु की।
20. परमाणु संख्या 16 वाले तत्त्वे की संयोजकता है
(a) 6
(b) 4
(c) 1
(d) 2
21. एक तत्त्व A की परमाणु संख्या 40 व तत्त्व B की परमाणु संख्या 11 है। A व B के विषय में कौन-सा कथन सत्य है-
(a) A, B से अधिक सक्रिय है।
(b) B, A से अधिक सक्रिय है।
(c) B रासायनिक रूप से अक्रिय
(d) A व B समान रूप से सक्रिय हैं।
22. निम्न में कौन-सा कथन असत्य है
(a) भारी तत्त्व रेडियोधर्मी होते हैं।
(b) α-कण धन आवेशिते हैं।
(c) β-कण आवेश रहित हैं।
(d) समस्थानिकों की परमाणु संख्या समान होती है।
23. कैल्सियम परमाणु संख्या 20 की संयोजकता है
(a) 1
(b) 2
(c) 3
(d) 6.
24. P-32 प्रयोग किया जाता है
(a) कैंसर
(b) थायरॉइड
(c) ल्यूकेमिया
(d) धमनी की रुकावट।
25. I-131 ……………के उपचार में प्रयोग किया जाता है।
(a) कैंसर के उपचार में
(b) थायरॉइड विकार में
(c) ल्यूकेमिया में
(d) धमनी की रुकावट में।
26. इलेक्ट्रॉन पर आवेश है
(a) 1.6 x 10-19 C
(b) 9.1 x 10-16 C
(c) 1.9 x 10-16 C
(d) 6.1 x 10-19 C
27. ……………… आवेश रहित हैं।
(a) न्यूट्रॉन
(b) प्रोटॉन
(c) इलेक्ट्रॉन
(d) इलेक्ट्रॉन व न्यूट्रॉन।
28. भारी तत्त्वों के नाभिक में ………. नहीं पाया जाता
(a) प्रोटॉन
(b) न्यूट्रॉन
(c) इलेक्ट्रॉन
(d) इलेक्ट्रॉन वे प्रोटॉन
29. हाइड्रोजन परमाणु में ………….. नहीं पाया जाता
(a) प्रोटॉन
(b) न्यूट्रॉन
(c) इलेक्ट्रॉन
(d) इलेक्ट्रॉन व प्रोटॉन।
30. कैथोड किरणों का प्रयोग सर्वप्रथम ……… किया।
(a) चैडविक ने
(b) जे. जे. टॉमसन ने
(c) नील बोर ने
(d) रदरफोर्ड ने।
31. सोने की पतली पन्नी पर α-कण की बौछार
वाला प्रयोग सर्वप्रथम किसने किया
(a) चैडविक ने
(b) जे. जे. टॉमसन ने
(c) नील बोर ने
(d) रदरफोर्ड ने।
32. न्यूट्रॉन की खोज की
(a) चैडविक ने
(b) जे. जे. टॉमसन ने
(c) नील बोर ने
(d) रदरफोर्ड ने।
33. इलेक्ट्रॉन होता है
(a) द्रव्यमान में प्रोटॉन का वां भाग व धन आवेशित
(b) द्रव्यमान में प्रोटॉन के बराबर व ऋण आवेशित
(c) द्रव्यमान में प्रोटॉन का 1/1838 व ऋण आवेशित
(d) द्रव्यमान में प्रोटॉन के बराबर व धन आवेशित
34. किसी परमाणु में प्रोटॉन की संख्या होती है
(a) न्यूट्रॉन के बराबर
(b) इलेक्ट्रॉन के बराबर
(c) परमाणु द्रव्यमान के बराबर
(d) कोई निश्चित नहीं।
35. यदि किसी तत्त्व के परमाणु में 9 प्रोटॉन व 10 न्यूट्रॉन हों तो उसका परमाणु द्रव्यमान है
(a) 19
(b) 9
(c) 10
(d) 1.
36. Na का परमाणु द्रव्यमान 23 व परमाणु क्रमांक 11 है तो उसके परमाणु में न्यूट्रॉन होंगे
(a) 11
(b) 12
(c) 23
(d) कोई निश्चित नहीं
37. संयोजकता इलेक्ट्रॉन परमाणु के ……. कक्ष में उपस्थित होते हैं।
(a) प्रथम कक्ष
(b) द्वितीय कक्ष
(c) बाह्यतम
(d) किसी भी।
38. यदि किसी तत्त्व का बाह्यतम कक्ष प्रथम कक्षे से तो वह बाह्यतम कक्ष में ……… इलेक्ट्रॉन होने पर ही अक्रिय गैस का विन्यास प्राप्त कर लेगा
(a) 2
(b) 4
(c) 6
(d) 8.
39. प्रत्येक तत्त्वं अपने बाह्यतम कक्ष में ……… इलेक्ट्रॉन पूरे करने का प्रयत्न करता है।
(a) 2
(b) 4
(c) 6
(d) 8.
उत्तरमाला
- (c)
- (d)
- (b)
- (a)
- (a)
- (c)
- (b)
- (a)
- (c)
- (d)
- (d)
- (d)
- (c)
- (b)
- (b)
- (c)
- (c)
- (d)
- (c)
- (d)
- (b)
- (c)
- (b)
- (c)
- (b)
- (a)
- (a)
- (c)
- (b)
- (b)
- (d)
- (a)
- (c)
- (b)
- (a)
- (b)
- (c)
- (a)
- (d)