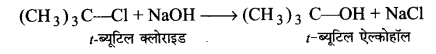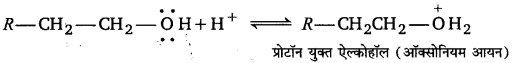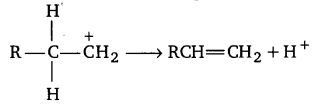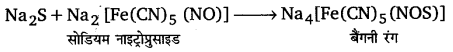NCERT Solutions Class 11 रसायन विज्ञान Chapter-12 (कार्बनिक रसायन : कुछ आधारभूत सिद्धान्त तथा तकनीकें)
Class 11 (रसायन विज्ञान )
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
पाठ-12 (कार्बनिक रसायन : कुछ आधारभूत सिद्धान्त तथा तकनीकें)
पाठ के अन्तर्गत दिए गए प्रश्नोत्तर
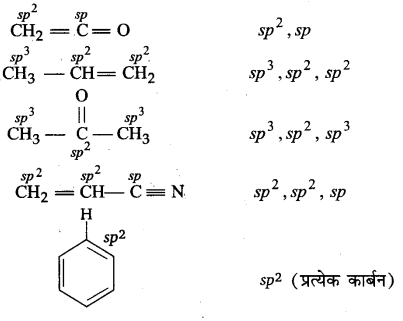
प्रश्न 1.
निम्नलिखित यौगिकों में प्रत्येक कार्बन की संकरण अवस्था बताइए-
उत्तर :
प्रश्न 2.
निम्नलिखित अणुओं में σ तथा π आबन्ध दर्शाइए-
C6H6, C6H12, CH2Cl2, CH2=C=CH, CH3NO2, HCONHCH3
उत्तर :
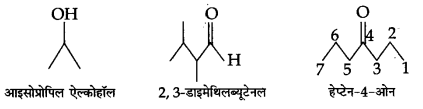
प्रश्न 3.
निम्नलिखित यौगिकों के आबन्ध-रेखा सूत्र लिखिए-
आइसोप्रोपिल ऐल्कोहॉल, 2, 3-डाइमेथिल ब्यूटेनल, हेप्टेन-4-ओन
उत्तर :
प्रश्न 4.
निम्नलिखित यौगिकों के IUPAC नाम लिखिए-
उत्तर :
(क) प्रोपिलबेन्जीन,
(ख) 3-मेथिलपेन्टेननाइट्राइल,
(ग) 2, 5-डाइमेथिलहेप्टेन,
(घ) 3-ब्रोमो-3-क्लोरोहेप्टेन,
(ङ) 3-क्लोरोप्रोपेनल,
(च) 2, 2-डाइक्लोरोएथेनॉल
प्रश्न 5.
निम्नलिखित यौगिकों में से कौन-सा नाम IUPAC पद्धति के अनुसार सही है?
(क) 2, 2-डाइएथिलपेन्टेन अथवा 2-डाइमेथिलपेन्टेन
(ख) 2, 4, 7-ट्राइमेथिलऑक्टेन अथवा 2, 5, 7-ट्राइमेथिलऑक्टेन
(ग) 2-क्लोरो-4-मेथिलपेन्टेन अथवा 4-क्लोरो-2-मेथिलपेन्टेन
(घ) ब्यूट-3-आइन-1-ऑल अथवा ब्यूट-4-ऑल-1-आइन
उत्तर :
(क) 2, 2-डाइमेथिलषन्टेन,
(ख) 2, 4, 7-ट्राइमेथिलऑक्टेन
(ग) 2-क्लोरो-4-मेथिलपेन्टेन,
(घ) ब्यूट-3-आइन-1-ऑल
प्रश्न 6.
निम्नलिखित दो सजातीय श्रेणियों में से प्रत्येक के प्रथम पाँच सजातों के संरचना-सूत्र लिखिए-
(क) HCOOH
(ख) CH3COCH3
(ग) H—CH=CH2
उत्तर :
प्रश्न 7.
निम्नलिखित के संघनितं और आबन्ध रेखा-सूत्र लिखिए तथा यदि कोई क्रियात्मक समूह हो तो उसे पहचानिए-:
(क) 2, 2, 4-टाइमेथिल पेन्टेन
(ख) 2-हाइड्रॉक्सी-1, 2, 3-प्रोषेनट्राइकार्बोक्सिलिक अम्ल
(ग) हेक्सेनडाइएल
उत्तर :
प्रश्न 8.
निम्नलिखित यौगिकों में क्रियात्मक समूह पहचानिए-
उत्तर :
प्रश्न 9.
निम्नलिखित में से कौन अधिक स्थायी है तथा क्यों?
O2NCH2CH2O– CH3CH2O–
उत्तर :
से अधिक स्थायी है क्योंकि NO2 का -1 प्रभाव होता है। अत: यह O– परमाणु पर ऋणावेश का परिक्षेपण करता है। इसके विपरीत, CH3CH2 का +1 प्रभाव होता है, अत: यह ऋणावेश की तीव्रता बढ़ाकर इसे अस्थायी करता है।
प्रश्न 10.
निकाय से आबन्धित होने पर ऐल्किल समूह इलेक्ट्रॉनदाता की तरह व्यवहार प्रदर्शित क्यों करते हैं? समझाइए।
उत्तर :
अतिसंयुग्मन के कारण -निकाय से आबन्धित होने पर ऐल्किल समूह इलेक्ट्रॉन दाता की तरह कार्य करते हैं जैसा कि नीचे प्रदर्शित है-
प्रश्न 11.
निम्नलिखित यौगिकों की अनुनाद संरचना लिखिए तथा इलेक्ट्रॉनों का विस्थापन मुड़े तीरों की सहायता से दर्शाइए-
(क) C6H5OH
(ख) C6H5NO2
(ग) CH3CH=CHCHO
(घ) C6H5–CHO
(ङ) C6H5–CH+2
(च) CH3CH=CHCH2
उत्तर :
प्रश्न 12.
इलेक्ट्रॉनस्नेहीं तथा नाभिकस्नेही क्या हैं? उदाहरण सहित समझाइए।
उत्तर :
नाभिकस्नेही और इलेक्ट्रॉनस्नेही (Nucleophiles and Electrophiles) इलेक्ट्रॉन-युग्म प्रदान करने वाला अभिकर्मक ‘नाभिकस्नेही’ (nucleophile, Nu : ) अर्थात् ‘नाभिक खोजने वाला’ कहलाता है तथा अभिक्रिया ‘नाभिकस्नेही अभिक्रिया’ (nucleophilic reaction) कहलाती है। इलेक्ट्रॉन युग्म ग्रहण करने वाले अभिकर्मक को इलेक्ट्रॉनस्नेही (electrophile E+), अर्थात् ‘इलेक्ट्रॉन चाहने वाला कहते हैं और अभिक्रिया ‘इलेक्ट्रॉनस्नेही अभिक्रिया’ । (electrophilic reaction) कहलाती है।
ध्रुवीय कार्बनिक अभिक्रियाओं में क्रियाधारक के इलेक्ट्रॉनस्नेही केन्द्र पर नाभिकस्नेही आक्रमण करता है। यह क्रियाधारक का विशिष्ट परमाणु अथवा इलेक्ट्रॉन न्यून भाग होता है। इसी प्रकार क्रियाधारकों के इलेक्ट्रॉनधनी नाभिकस्नेही केन्द्र पर इलेक्ट्रॉनस्नेही आक्रमण करता है। अतः आबन्धन अन्योन्यक्रिया के फलस्वरूप इलेक्ट्रॉनस्नेही से इलेक्ट्रॉन-युग्म प्राप्त करता है। नाभिकस्नेही से इलेक्ट्रॉनस्नेही की ओर इलेक्ट्रॉनों का संचलन वक्र तीर द्वारा प्रदर्शित किया जाता है। नाभिकस्नेही के उदाहरणों में हाइड्रॉक्साइड (OH–), सायनाइड आयन (CN– ) तथा कार्बऋणायन  कुछ आयन सम्मिलित हैं। इसके अतिरिक्त कुछ उदासीन अणु, (जैसे-
कुछ आयन सम्मिलित हैं। इसके अतिरिक्त कुछ उदासीन अणु, (जैसे-  आदि) भी एकाकी इलेक्ट्रॉन-युग्म की उपस्थिति के कारण नाभिकस्नेही की भाँति कार्य करते हैं। इलेक्ट्रॉनस्नेही के उदाहरणों में कार्बधनायन
आदि) भी एकाकी इलेक्ट्रॉन-युग्म की उपस्थिति के कारण नाभिकस्नेही की भाँति कार्य करते हैं। इलेक्ट्रॉनस्नेही के उदाहरणों में कार्बधनायन  और कार्बोनिल समूह
और कार्बोनिल समूह  अथवा ऐल्किल हैलाइड (R3C—X, X= हैलोजेन परमाणु) वाले। उदासीन अणु सम्मिलित हैं। कार्बधनायन का कार्बन केवल षष्टक होने के कारण इलेक्ट्रॉन-न्यून होता है तथा नाभिकस्नेही से इलेक्ट्रॉन-युग्म ग्रहण कर सकता है। ऐल्किल हैलाइड का कार्बन आबन्ध ध्रुवता के कारण इलेक्ट्रॉनस्नेही–केन्द्र बन जाता है जिस पर नाभिकस्नेही आक्रमण कर सकता है।
अथवा ऐल्किल हैलाइड (R3C—X, X= हैलोजेन परमाणु) वाले। उदासीन अणु सम्मिलित हैं। कार्बधनायन का कार्बन केवल षष्टक होने के कारण इलेक्ट्रॉन-न्यून होता है तथा नाभिकस्नेही से इलेक्ट्रॉन-युग्म ग्रहण कर सकता है। ऐल्किल हैलाइड का कार्बन आबन्ध ध्रुवता के कारण इलेक्ट्रॉनस्नेही–केन्द्र बन जाता है जिस पर नाभिकस्नेही आक्रमण कर सकता है।
प्रश्न 13.
निम्नलिखित समीकरणों में रेखांकित अभिकर्मकों को नाभिकस्नेही तथा इलेक्ट्रॉनस्नेही में वर्गीकृत कीजिए-
उत्तर :
(क) नाभिकस्नेही,
(ख) नाभिकस्नेही
(ग) इलेक्ट्रॉनस्नेही।
प्रश्न 14.
निम्नलिखित अभिक्रियाओं को वर्गीकृत कीजिए-
(क) CH3CH2Br+HS– CH3CH2SH+Br–
(ख) (CH3)2C=CH2+HCl → (CH3)2CIC-CH3
(ग) CH2CH2Br+HO– → CH2=CH2+H2O+Br–
(घ) (CH3)3C-CH2OH+HBr → (CH3)2CBrCH2CH3 + H2O
उत्तर :
(क) नाभिकस्नेही प्रतिस्थापन (Nucleophilic substitution)
(ख) इलेक्ट्रॉनस्नेही योगात्मक (Electrophilic addition)
(ग) विलोपन (Elimination)
(घ) पुनर्विन्यास युक्त नाभिकस्नेही प्रतिस्थापन (Nucleophilic substitution with rearrangement)
प्रश्न 15.
निम्नलिखित युग्मों में सदस्य-संरके मध्य कैसा सम्बन्ध है? क्या ये संरचनाएँ संरचनात्मक या ज्यामितीसमवयव अथवा अनुनाद संरचनाएँ हैं।
उत्तर :
(क) स्थिति समावयवी और मध्यावयवी
(ख) ज्यामितीय समावयवी,
(ग) अनुनाद संरचनाएँ।
प्रश्न 16.
निम्नलिखित आबन्ध विदलनों के लिए इलेक्ट्रॉन विस्थापन को मुड़े तीरों द्वारा दर्शाइए तथा प्रत्येक विदलन को समांश अथवा विषमांश में वर्गीकृत कीजिए। साथ ही निर्मित सक्रिय मध्यवर्ती उत्पादों में मुक्त-मूलक, कार्बधनायन तथा कार्बऋणायन पहचानिए-
उत्तर :
प्रश्न 17.
प्रेरणिक तथा इलेक्ट्रोमेरी प्रभावों की व्याख्या कीजिए। निम्नलिखित कार्बोक्सिलिक अम्लों की अम्लता का सही क्रम कौन-सा इलेक्ट्रॉन-विस्थापन वर्णित करता है?
(क) Cl3CCOOH > Cl2CHCOOH > ClCH2COOH
(ख) CH3CH2COOH > (CH3)2CHCOOH > (CH3)3C.COOH
उत्तर :
प्रेरणिक प्रभाव (Inductive Effect, I-effect)-भिन्न विद्युत-ऋणात्मकता के दो परमाणुओं के मध्य निर्मित सहसंयोजक आबन्ध में इलेक्ट्रॉन असमान रूप से सहभाजित होते हैं। इलेक्ट्रॉन घनत्व उच्च विद्युत ऋणात्मकता के परमाणु के ओर अधिक होता है। इस कारण सहसंयोजक आबन्ध ध्रुवीय हो जाता है। आबन्ध ध्रुवता के कारण कार्बनिक अणुओं में विभिन्न इलेक्ट्रॉनिक प्रभाव उत्पन्न होते हैं।
उदाहरणार्थ-क्लोरोएथेन (CH3CH2Cl) में C—Cl बन्ध ध्रुवीय है। इसकी ध्रुवता के कारण कार्बन क्रमांक-1 पर आंशिक धनावेश (δ+) तथा क्लोरीन पर आंशिक ऋणावेश (δ–) उत्पन्न हो जाता है। आंशिक आवेशों को दर्शाने के लिए δ (डेल्टा) चिह्न प्रयुक्त करते है। आबन्ध में इलेक्ट्रॉन-विस्थापन दर्शाने के लिए तीर (→) का उपयोग किया जाता है, जो 8′ से 6 की ओर आमुख होता है।
कार्बन-1 अपने आंशिक धनावेश के कारण पास के C—C आबन्ध के इलेक्ट्रॉनों को अपनी ओर आकर्षित करने लगता है। फलस्वरूप कार्बन-2 पर भी कुछ धनावेश (∆δ+) उत्पन्न हो जाता है। C—1 पर स्थित धनावेश की तुलना में ∆δ+ अपेक्षाकृत कम धनावेश दर्शाता है। दूसरे शब्दों में, C—CI की ध्रुवता के कारण पास के आबन्ध में ध्रुवता उत्पन्न हो जाती है। समीप के ठ-आबन्ध के कारण अगले 6-आबन्ध के ध्रुवीय होने की प्रक्रिया प्रेरणिक प्रभाव (inductive effect) कहलाती है। यह प्रभाव आगे के आबन्धों तक भी जाता है, लेकिन आबन्धों की संख्या बढ़ने के साथ-साथ यह प्रभाव कम होता जाता है और तीन आबन्धों के बाद लगभग लुप्त हो जाता है। प्रेरणिक प्रभाव का सम्बन्ध प्रतिस्थापी से बन्धित कार्बन परमाणु को इलेक्ट्रॉन प्रदान करने अथवा अपनी ओर आकर्षित कर लेने की योग्यता से है। इस योग्यता के आधार पर प्रतिस्थापियों को हाइड्रोजन के सापेक्ष इलेक्ट्रॉन-आकर्षी (electron-withdrawing) या इलेक्ट्रॉनदाता समूह के रूप में वर्गीकृत किया जाता है। हैलोजन तथा कुछ अन्य समूह; जैसे-नाइट्रो (—NO2), सायनो (—CN), कार्बोक्सी (—COOH), एस्टर (—COOR), ऐरिलॉक्सी (—OAr) इलेक्ट्रॉन आकर्षी समूह हैं; जबकि ऐल्किल समूह; जैसे—मेथिल (—CH3), एथिल (—CH2—CH3)आदि इलेक्ट्रॉनदाता समूह हैं।
इलेक्ट्रोमेरी प्रभाव (E प्रभाव) [Electromeric Effect, E-effect]-यह एक अस्थायी प्रभाव है। केवल आक्रमणकारी अभिकारकों की उपस्थिति में यह प्रभाव बहुआबन्ध (द्विआबन्ध अथवा त्रिआबन्ध) वाले कार्बनिक यौगिकों में प्रदर्शित होता है। इस प्रभाव में आक्रमण करने वाले अभिकारके की माँग के कारण बहु-आबन्ध से बन्धित परमाणुओं में एक सहभाजित -इलेक्ट्रॉन युग्म का पूर्ण विस्थापन होता है। अभिक्रिया की परिधि से आक्रमणकारी अभिकारक को हटाते ही यह प्रभाव शून्य हो। जाता है। इसे E द्वारा दर्शाया जाता है, जबकि इलेक्ट्रॉन के संचलन को वक्र तीर  द्वारा प्रदर्शित । किया जाता है। स्पष्टतः दो प्रकार के इलेक्ट्रोमेरी प्रभाव होते हैं-
द्वारा प्रदर्शित । किया जाता है। स्पष्टतः दो प्रकार के इलेक्ट्रोमेरी प्रभाव होते हैं-
(i) धनात्मक इलेक्ट्रोमेरी प्रभाव (+E प्रभाव)-इस प्रभाव में बहुआबन्ध के ए-इलेक्ट्रॉनों का स्थानान्तरण उस परमाणु पर होता है जिससे आक्रमणकारी अभिकर्मक बन्धित होता है।
उदाहरणार्थ-
(ii) ऋणात्मक इलेक्ट्रोमेरी प्रभाव(-E प्रभाव)—इस प्रभाव में बहु-आबन्ध के -इलेक्ट्रॉनों का स्थानान्तरण उस परमाणु पर होता है जिससे आक्रमणकारी अभिकर्मक बन्धित नहीं होता है। इसका
उदाहरण निम्नलिखित है-
जब प्रेरणिक तथा इलेक्ट्रोमेरी प्रभाव एक-दूसरे की विपरीत दिशाओं में कार्य करते हैं, तब इलेक्ट्रोमेरिक प्रभाव प्रबल होता है।
(क) Cl3CCOOH > Cl2CHCOOH > ClCH2COOH
यह इलेक्ट्रॉन आकर्षी प्रेरणिक प्रभाव (-I) दर्शाता है।
(ख) CH3CH2COOH > (CH3)2CHCOOH > (CH3)3C.COOH
यह इलेक्ट्रॉन दाता प्रेरणिक प्रभाव (+I) दर्शाता है।
प्रश्न 18.
प्रत्येक का एक उदाहरण देते हुए निम्नलिखित प्रक्रमों के सिद्धान्तों का संक्षिप्त विवरण दीजिए
(क) क्रिस्टलन,
(ख) आसवन,
(ग) क्रोमैटोग्रैफी।
उत्तर :
(क) क्रिस्टलन (Crystallisation)—यह ठोस कार्बनिक पदार्थों के शोधन की प्रायः प्रयुक्त विधि है। यह विधि कार्बनिक यौगिक तथा अशुद्धि की किसी उपयुक्त विलायक में इनकी विलेयताओं में निहित अन्तर पर आधारित होती है। अशुद्ध यौगिक को किसी ऐसे विलायक में घोलते हैं जिसमें यौगिक सामान्य ताप पर अल्प-विलेय (sparingly soluble) होता है, परन्तु उच्चतर ताप परे यथेष्ट मात्रा में वह घुल जाता है। तत्पश्चात् विलयन को इतना सान्द्रित करते हैं कि वह लगभग संतृप्त (saturate) हो जाए। विलयन को ठण्डा करने पर शुद्ध पदार्थ क्रिस्टलित हो जाता है जिसे निस्यन्दन द्वारा पृथक् कर लेते हैं। निस्यन्द (मातृ द्रव) में मुख्य रूप से अशुद्धियाँ तथा यौगिक की अल्प मात्रा रह जाती है। यदि यौगिक किसी एक विलायक में अत्यधिक विलेय तथा किसी अन्य विलायक में अल्प
विलेय होता है, तब क्रिस्टलन उचित मात्रा में इन विलायकों को मिश्रित करके किया जाता है। सक्रियिंत काष्ठ कोयले'(activated charcoal) की सहायता से रंगीन अशुद्धियाँ निकाली जाती हैं। यौगिक तथा अशुद्धियों की विलेयताओं में कम अन्तर होने की दशा में बार-बार क्रिस्टलन द्वारा शुद्ध यौगिक प्राप्त किया जाता है।
(ख) आसवन (Distillation)—इस महत्त्वपूर्ण विधि की सहायता से (i) वाष्पशील (volatile) द्रवों को अवाष्पशील अशुद्धियों से एवं (ii) ऐसे द्रवों को, जिनके क्वथनांकों में पर्याप्त अन्तर हो, पृथक् कर सकते हैं। भिन्न क्वथनांकों वाले द्रव भिन्न ताप पर वाष्पित होते हैं। वाष्पों को ठण्डा करने से प्राप्त द्रवों को अलग-अलग एकत्र कर लेते हैं। क्लोरोफॉर्म (क्वथनांक 334K) और ऐनिलीन (क्वथनांक 457 K) को आसवन विधि द्वारा आसानी से पृथक् कर सकते हैं। द्रव-मिश्रण को गोल पेंदे वाले फ्लास्क में लेकर हम सावधानीपूर्वक गर्म करते हैं। उबालने पर कम क्वथनांक वाले द्रव की वाष्प पहले बनती है। वाष्प को संघनित्र की सहायता से संघनित करके प्राप्त द्रव को ग्राही में एकत्र कर लेते हैं। उच्च क्वथनांक वाले घटक के वाष्प बाद में बनते हैं। इनमें संघनन से प्राप्त द्रव को दूसरे ग्राही में एकत्र कर लेते हैं।
(ग) वर्णलेखन (Chromatography)-‘वर्णलेखन (क्रोमैटोग्रफी) शोधन की एक अत्यन्त महत्त्वपूर्ण तकनीक है जिसका उपयोग यौगिकों का शोधन करने में, किसी मिश्रण के अवयवों को पृथक् करने तथा यौगिकों की शुद्धता की जाँच करने के लिए विस्तृत रूप से किया जाता है। क्रोमैटोग्रफी विधि का उपयोग सर्वप्रथम पादपों में पाए जाने वाले रंगीन पदार्थों को पृथक् करने के लिए किया गया था। ‘क्रोमैटोग्रैफी’ शब्द ग्रीक शब्द क्रोमा’ (chroma) से बना है जिसका अर्थ है ‘रंग’। इस तकनीक में सर्वप्रथम यौगिकों के मिश्रण को स्थिर प्रावस्था (stationary phase) पर अधिशोषित कर दिया जाता है। स्थिर प्रावस्था ठोस अथवा द्रव हो सकती है। इसके पश्चात् स्थिर प्रावस्था में से उपयुक्त विलायक, विलायकों के मिश्रणं अथवा गैस को धीरे-धीरे प्रवाहित किया जाता है। इस प्रकार मिश्रण के अवयव क्रमशः एक-दूसरे से पृथक् हो जाते हैं। गति करने वाली प्रावस्था को ‘गतिशील प्रावस्था (mobile phase) कहते हैं। अन्तर्ग्रस्त सिद्धान्तों के आधार पर वर्णलेखन को विभिन्न वर्गों में वर्गीकृत किया गया है। इनमें से दो हैं-
1. अधिशोषण-(वर्णलेखन) (Adsorption chromatography)—यह इस सिद्धान्त पर आधारित है कि किसी विशिष्ट अधिशोषक’ (adsorbent) पर विभिन्न यौगिक भिन्न अंशों में अधिशोषित होते हैं। साधारणतः ऐलुमिना तथा सिलिका जेल अधिशोषक के रूप में प्रयुक्त किए जाते हैं। स्थिर प्रावस्था (अधिशोषक) पर गतिशील प्रावस्था प्रवाहित करने के उपरान्त मिश्रण के अवयव स्थिर प्रावस्था पर अलग-अलग दूरी तय करते हैं। निम्नलिखित दो प्रकार की वर्णलेखन-तकनीकें हैं, जो विभेदी-अधिशोषण सिद्धान्त पर आधारित हैं-
- कॉलम-वर्णलेखन अर्थात् स्तम्भ-वर्णलेखन (Column Chromatography)
- पतली पर्त वर्णलेखन (Thin Layer Chromatography)
2. वितरण क्रोमैटोग्रैफी (Partition chromatography)–वितरण क्रोमैटोग्रॅफी स्थिर तथा गतिशील प्रावस्थाओं के मध्य मिश्रण के अवयवों के सतत् विभेदी वितरण पर आधारित है। कागज वर्णलेखन (paper chromatography) इसका एक उदाहरण है। इसमें एक विशिष्ट प्रकार के क्रोमैटोग्रॅफी कागज का इस्तेमाल किया जाता है। इस कागज के छिद्रों में जल-अणु पाशित रहते हैं, जो स्थिर प्रावस्था का कार्य करते हैं।
प्रश्न 19.
ऐसे दो यौगिकों, जिनकी विलेयताएँ विलायक s, में भिन्न हैं, को पृथक करने की विधि की व्याख्या कीजिए।
उत्तर :
ऐसे दो यौगिकों, जिनकी विलेयताएँ विलायक s, में भिन्न हैं, को पृथक् करने के लिए। क्रिस्टलन विधि प्रयोग की जाती है। इस विधि में अशुद्ध यौगिक को किसी ऐसे विलायक में घोलते हैं। जिसमें यौगिक सामान्य ताप पर अल्प-विलेय तथा उच्च ताप पर विलेय होता है। इसके पश्चात् विलयन को सान्द्रित करते हैं जिससे वह लगभग संतृप्त हो जाए। अब अल्प-विलेय घटक पहले क्रिस्टलीकृत हो जाएगा तथा अधिक विलेय घटक पुनः गर्म करके ठण्डा करने पर क्रिस्टलीकृत होगा। इसके अतिरिक्त सक्रियित काष्ठ कोयले की सहायता से रंगीन अशुद्धियाँ निकाल दी जाती हैं। यौगिक तथा अशुद्धि की विलेयताओं में कम अन्तर होने पर बार-बार क्रिस्टलन करने पर शुद्ध यौगिक प्राप्त किया जाता है।
प्रश्न 20.
आसवन, निम्न दाब पर आसवन तथा भाप आसवन में क्या अन्तर है? विवेचना कीजिए।
उत्तर :
आसवन का तात्पर्य द्रव का वाष्प में परिवर्तन तथा वाष्प का संघनित होकर शुद्ध द्रव देना है। इस विधि का प्रयोग उन द्रवों के शोधन में किया जाता है जो बिना अपघटित हुए उबलते हैं तथा जिनमें अवाष्पशील अशुद्धियाँ होती हैं।
निम्न दाब पर आसवन में भी गर्म करने पर द्रव वाष्प में परिवर्तित होता है तथा संघनित होकर शुद्ध द्रव देता है परन्तु यहाँ निकाये पर कार्यरत् दाब वायुमण्डलीय दाब नहीं होता है; उसे निर्वात् पम्प की सहायता से घटा दिया जाता है। दाब घटाने पर द्रव का क्वथनांक घट जाता है। अतः इस विधि का प्रयोग उन द्रवों के शोधन में किया जाता है जिनके क्वथनांक उच्च होते हैं या वे अपने क्वथनांक से नीचे अपघटित हो जाते हैं।
भाप आसवन कम दाब पर आसवन के समान होता है लेकिन इसमें कुल दाब में कोई कमी नहीं आती है। इसमें कार्बनिक द्रव तथा जल उस ताप पर उबलते हैं जब कार्बनिक द्रव का वाष्प दाब (p1) तथा जल का वाष्प दाब (p2) वायुमण्डलीय दाब (p) के बराबर हो जाते हैं।
p= p1 + p-कक्षकों
इस स्थिति में कार्बनिक द्रव अपने सामान्य क्वथनांक से कम ताप पर उबलता है जिससे उसका अपघटन नहीं होता है।
प्रश्न 21.
लैंसे-परीक्षण का रसायन-सिद्धान्त समझाइए।
उत्तर :
किसी कार्बनिक यौगिक में शुपस्थित नाइट्रोजन, सल्फर, हैलोजेन तथा फॉस्फोरस की पहचान ‘लैंसे-परीक्षण’ (Lassaigne’s Test) द्वारा की जाती है। यौगिक को सोडियम धातु के साथ संगलित करने पर ये तत्व सहसंयोजी रूप से आयनिक रूप में परिवर्तित हो जाते हैं। इनमें निम्नलिखित अभिक्रियाएँ होती हैं-
C, N, S तथा X कार्बनिक यौगिक में उपस्थित तत्व हैं। सोडियम संगलन से प्राप्त अवशेष को आसुत जल के साथ उबालने पर सोडियम सायनाइड, सल्फाइड तथा हैलाइड जल में घुल जाते हैं। इस निष्कर्ष को ‘सोडियम संगलन निष्कर्ष’ (Sodium Fusion Extract) कहते हैं।
प्रश्न 22.
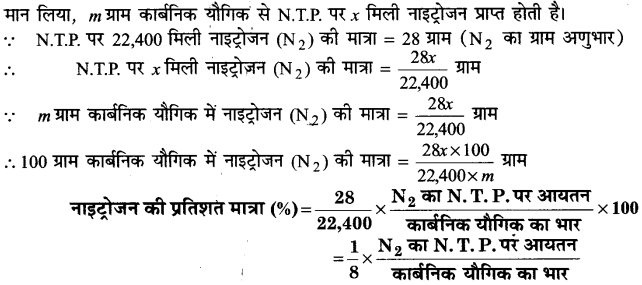
किसी कार्बनिक यौगिक में नाइट्रोजन के आकलन की (i) ड्यूमा विधि तथा (ii) कैल्डाल विधि के सिद्धान्त की रूपरेखा प्रस्तुत कीजिए।
उत्तर :
नाइट्रोजन के परिमाणात्मक निर्धारण की निम्नलिखित दो विधियाँ प्रयुक्त की जाती हैं-
(i) ड्यूमा विधि (Duma’s Method)–नाइट्रोजनयुक्त कार्बनिक यौगिक क्यूप्रिक ऑक्साइड के साथ गर्म करने पर इसमें उपस्थित कार्बन, हाइड्रोजन, गन्धक तथा नाइट्रोजन क्रमशः CO2, H2O, SO2 और नाइट्रोजन के ऑक्साइडों (NO2, NO, N2O) के रूप में ऑक्सीकृत हो जाते हैं। इस गैसीय मिश्रण को रक्त तप्त कॉपर की जाली के ऊपर प्रवाहित करने पर नाइट्रोजन के ऑक्साइडों का नाइट्रोजन में अपचयन हो जाता है।
4Cu + 2NO2 → 4CuO + N2 ↑
2Cu +2NO → 2CuO +N2 ↑
Cu +N2O → CuO + N2 ↑
इस प्रकार N2, CO2, H2O तथा SO2 युक्त गैसीय मिश्रण को KOH से भरी नाइट्रोमीटर नामक अंशांकित नली में प्रवाहित करने पर CO2, H2O तथा SO2 का KOH द्वारा अवशोषण हो जाता है। और बची हुई N2 गैस को नाइट्रोमीटर में जल के ऊपर एकत्र कर लिया जाता है। इस नाइट्रोजन का आयतन वायुमण्डल के दाब तथा ताप पर नोट कर लेते हैं। फिर इस आयतन को गैस समीकरण की सहायता से सामान्य ताप व दाब (N.T.P) पर परिवर्तित कर लेते हैं।
(ii) कैल्डाल विधि (Kjeldahl’s Method)-यह विधि इस सिद्धान्त पर आधारित है कि जब किसी नाइट्रोजनयुक्त कार्बन यौगिक को पोटैशियम सल्फेट की उपस्थिति में सान्द्र H2SO4 के साथ गर्म करते हैं तो उसमें उपस्थित नाइट्रोजन पूर्णरूप से अमोनियम सल्फेट में परिवर्तित हो जाती है। इस प्रकार प्राप्त अमोनियम सल्फेट को साद्र कॉस्टिक सोडा विलयन के साथ गर्म करने पर अमोनिया गैस निकलती है जिसको ज्ञात सान्द्रण वाले H2SO4 के निश्चित आयतन में अवशोषित कर लेते हैं। इस अम्ल का मानक NaOH के साथ अनुमापन करके गणना द्वारा अवशोषित हुई अमोनिया की मात्रा ज्ञात की जाती है। फिर नाइट्रोजन के आयतन की गणना कर ली जाती है।
(NH4)2SO4 + 2NaOH → Na2SO4 + 2H2O + 2NH3↑
2NH3 + H2SO4 → (NH4)2SO4
मान लिया, कार्बनिक यौगिक का भार = m
प्रयुक्त अम्ल का आयतन =y मिली
प्रयुक्त अम्ल की नॉर्मलता = N
प्रश्न 23.
किसी यौगिक में हैलोजेन, सल्फर तथा फॉस्फोरस के आकलन के सिद्धान्त की विवेचना कीजिए।
उत्तर :
(i) हैलोजेन का आकलन (Estimation of Halogens)
कार्बनिक यौगिक के ज्ञात भार को सधूम HNO3 तथा AgNO3 के कुछ क्रिस्टलों के साथ केरियस नली में लेते हैं। नली का ऊपरी सिरा बन्द कर दिया जाता है। केरियस नली को विद्युत भट्टी में रखकर 180°-200°C पर लगभग 3-4 घण्टे गर्म करते हैं। यौगिक में उपस्थित हैलोजेन (Cl, Br, I), सिल्वर हैलाइड के अवक्षेप में बदल जाते हैं। सिल्वर हैलाइड के अवक्षेप को धोकर तथा सुखाकर तौल लेते हैं। इस प्रकार प्राप्त सिल्वर हैलाइड के भार से हैलोजेन की प्रतिशत मात्रा निम्नलिखित गणना की सहायता से ज्ञात कर लेते हैं-
(ii) सल्फर का आकलन (Estimation of Sulphur)
इस सिद्धान्त के अनुसार, सल्फरयुक्त कार्बनिक यौगिक को सान्द्र नाइट्रिक अम्ल के साथ गर्म करने पर यौगिक में उपस्थित समस्त गन्धक, सल्फ्यूरिक अम्ल में ऑक्सीकृत हो जाती है। इसमें BaCl2 विलयन मिलाकर इससे BaSO4 अवक्षेपित कर लिया जाता है। इस अवक्षेप को छानकर, धोकर और सुखाकर तौल लेते हैं। इस प्रकार BaSO4 के भार की सहायता से गन्धक की प्रतिशत मात्रा की गणना कर लेते हैं।
अभिक्रियाएँ-
(iii) फॉस्फोरस का आकंलन (Estimation of Phosphorus)
कार्बनिक यौगिक की एक ज्ञातं मात्रा को सधूम नाइट्रिक अम्ल के साथ गर्म करने पर उसमें उपस्थित फॉस्फोरस, फॉस्फोरिक अम्ल में ऑक्सीकृत हो जाता है। इसे अमोनिया तथा अमोनियम मॉलिब्डेट मिलाकर अमोनियम फॉस्फोटोमॉलिब्डेट,(NH4)3 PO4.12MoO3 के रूप में हम अवक्षेपित कर लेते हैं, अन्यथा फॉस्फोरिक अम्ल में मैग्नीशिया मिश्रण मिलाकर MgN4PO4के रूप में अवक्षेपित किया जा सकता है जिसके ज्वलन से Mg2P2O7प्राप्त होता है।
माना कि कार्बनिक यौगिक का द्रव्यमान = m ग्राम और
अमोनियम फॉस्फोमॉलिब्डेट = m1 ग्राम
जहाँ Mg2P2O7 का मोलर द्रव्यमान 222 u,, लिए गए कार्बनिक पदार्थ का द्रव्यमान का बने हुए Mg2P2O7 का द्रव्यमान m1तथा Mg2P2O7) यौगिक में उपस्थित दो फॉस्फोरस परमाणुओं का द्रव्यमान 62 है।
प्रश्न 24.
पेपर क्रोमैटोग्रॅफी के सिद्धान्त को समझाइए।
उत्तर :
पेपर क्रोमैटोग्रैफी (Paper Chromatography) पेपर क्रोमैटोग्रॅफी वितरण क्रोमैटोग्रॅफी का एक प्रकार है। कागज अथवा पेपर क्रोमैटोग्रफी में एक विशिष्ट प्रकार का क्रोमैटोग्रफी पेपर प्रयोग किया जाता है। इस पेपर के छिद्रों में जल-अणु पाशित रहते हैं, जो स्थिर प्रावस्था का कार्य करते हैं।
क्रोमैटोग्रॅफी कागज की एक पट्टी (strip) के आधार पर मिश्रण का बिन्दु लगाकर उसे जार में लटका देते हैं (चित्र-4)। जार में कुछ ऊँचाई तक उपयुक्त विलायक अथवा विलायकों का मिश्रण भरा होता है, जो गतिशील प्रावस्था का कार्य करता है। केशिका क्रिया के कारण पेपर की पट्टी पर विलायके ऊपर की ओर बढ़ता है तथा बिन्दु पर प्रवाहित होता है। विभिन्न यौगिकों का दो प्रावस्थाओं में वितरण भिन्न-भिन्न होने के कारण वे अलग-अलग दूरियों तक आगे बढ़ते हैं। इस प्रकार विकसित पट्टी को ‘क्रोमैटोग्राम’ (chromatogram) कहते हैं। पतली पर्त की भाँति पेपर की पट्टी पर विभिन्न बिन्दुओं की स्थितियों को या तो पराबैंगनी प्रकाश के नीचे रखकर या उपयुक्त अभिकर्मक के विलयन को छिड़ककर हम देख लेते हैं।
प्रश्न 25.
‘सोडियम संगलने निष्कर्ष में हैलोजेन के परीक्षण के लिए सिल्वर नाइट्रेट मिलाने से पूर्व नाइट्रिक अम्ल क्यों मिलाया जाता है?
उत्तर :
NaCN तथा Na2S को विघटित करने के लिए सोडियम निष्कर्ष को नाइट्रिक अम्ल के साथ उबाला जाता है।
NaCN+ HNO3 → NaNO3 + HCN↑
Na2S + 2HNO3 → 2NaNO3 + H2S ↑
यदि वे विघटित नहीं होते हैं तब वे AgNO3 से अभिक्रिया करके परीक्षण में निम्न प्रकार बाधा पहुँचाते हैं-
प्रश्न 26.
नाइट्रोजन, सल्फर तथा फॉस्फोरस के परीक्षण के लिए सोडियम के साथ कार्बनिक यौगिक का संगलन क्यों किया जाता है?
उत्तर :
कार्बनिक यौगिक का सोडियम के साथ संगलन सह-संयोजी रूप में उपस्थित इन तत्त्वों को आयनिक रूप में परिवर्तित करने के लिए किया जाता है।
प्रश्न 27.
कैल्सियम सल्फेट तथा कपूर के मिश्रण के अवयवों को पृथक करने के लिए एक उपयुक्त तकनीक बताइए।
उत्तर :
कैल्सियम सल्फेट तथा कपूर के मिश्रण को निम्न विधियों द्वारा पृथक् किया जा सकता है-
- कपूर ऊर्ध्वपातनीय है लेकिन कैल्सियम सल्फेट नहीं। अत: मिश्रण को ऊर्ध्वपातित करने पर कपूर फनल के किनारों पर प्राप्त हो जाता है जबकि कैल्सियम सल्फेट चाइना डिश में शेष रह जाता है।
- कपूर कार्बनिक विलायकों, जैसे- CCl4, CHCl3 आदि में विलेय होता है लेकिन कैल्सियम सल्फेट नहीं। अतः मिश्रण को कार्बनिक विलायक के साथ हिलाने पर कपूर विलयन में चला जाता है जबकि CaSO4 अपशिष्ट रूप में रहता है। विलयन को छानकर, वाष्पित करके कपूर को प्राप्त कर लेते हैं।
प्रश्न 28.
भाप-आसवन करने पर एक कार्बनिक द्रव अपने क्वथनांक से निम्न ताप पर वाष्पीकृत। क्यों हो जाता है?
उत्तर :
भाप आसवन में, कार्बनिक द्रव और जल का मिश्रण उस ताप पर उबलता है जिस पर द्रव तथा जल के दाबों का योग वायुमंडलीय दाब के बराबर हो जाता है। मिश्रण के क्वथनांक पर जल का वाष्प दाब उच्च तथा द्रव का वाष्प दाब अत्यधिक कम (10-15mm) होता है अत: कार्बनिक द्रव वायुमंडलीय दाब से कम दाब पर आसवित हो जाता है अर्थात् कार्बनिक द्रव अपने सामान्य क्वथनांक से कम ताप पर ही आसवित हो जाता है।
प्रश्न 29.
क्या CCl4 सिल्वर नाइट्रेट के साथ गर्म करने पर AgCl का श्वेत अवक्षेप देगा? अपने उत्तर को कारण सहित समझाइए।
उत्तर :
AgCl का अवक्षेप नहीं बनेगा क्योंकि CCl4 सहसंयोजी यौगिक है तथा आयनित होकर Cl आयन नहीं देता है।
प्रश्न 30.
किसी कार्बनिक यौगिक में कार्बन का आकलन करते समय उत्पन्न कार्बन डाइऑक्साइड को अवशोषित करने के लिए पोटैशियम हाइड्रॉक्साइड विलयन का उपयोग क्यों किया जाता है?
उत्तर :
CO2 अम्लीय प्रकृति की होती है तथा प्रबल क्षार KOH से क्रिया करके K2CO3 बनाती है।
2KOH+ CO2 →K2CO3 + H2OAr
इससे KOH का द्रव्यमान बढ़ जाता है। निर्मित CO2 के कारण द्रव्यमान में वृद्धि से कार्बनिक यौगिक में उपस्थित कार्बन की मात्रा की गणना निम्न सम्बन्ध का प्रयोग करके की जाती है
प्रश्न 31.
सल्फर के लेड ऐसीटेटू द्वारा परीक्षण में सोडियम संगलन निष्कर्ष को ऐसीटिक अम्ल द्वारा उदासीन किया जाता है, न कि सल्फ्यूरिक अम्ल द्वारा। क्यों?
उत्तर :
सल्फर के परीक्षण में सोडियम निष्कर्ष को CH3COOH से अम्लीकृत करते हैं क्योकि लेड ऐसीटेट विलेय होता है तथा परीक्षण में बाधा उत्पन्न नहीं करता है। यदि H2SO4का प्रयोग किया जाए तब लेड ऐसीटेट H2SO4 से क्रिया करके लेड सल्फेट का सफेद अवक्षेप बनाता है जो परीक्षण में बाधा उत्पन्न करता है।
प्रश्न 32.
एक कार्बनिक यौगिक में 69% कार्बन, 4.8% हाइड्रोजन तथा शेष ऑक्सीजन है। इस यौगिक के 0.20 g के पूर्ण दहन के फलस्वरूप उत्पन्न कार्बन डाइऑक्साइड तथा जल की मात्राओं की गणना कीजिए।
उत्तर :
प्रश्न 33.
0.50 g कार्बनिक यौगिक को कैल्डाल विधि के अनुसार उपचारित करने पर प्राप्त अमोनिया को 0.5 M H2SO4 के 50 mL में अवशोषित किया गया। अवशिष्ट अम्ल के उदासीनीकरण के लिए 0.5 M NaOH के 50 mL की आवश्यकता हुई। यौगिक में नाइट्रोजन प्रतिशतता की गणना कीजिए।
उत्तर :
प्रश्न 34.
केरियस आकलन में 0.3780 g’कार्बनिक क्लोरो यौगिक से 0.5740 g सिल्वर क्लोराइड प्राप्त हुआ। यौगिक में क्लोरीन की प्रतिशतता की गणना कीजिए।
उत्तर :
प्रश्न 35.
केरियस विधि द्वारा सल्फर के आकलन में 0.468 g सल्फरयुक्त कार्बनिक यौगिक से 0.668 g बेरियम सल्फेट प्राप्त हुआ। दिए गए कार्बन यौगिक में सल्फर की प्रतिशतता की गणना कीजिए।
उत्तर :
प्रश्न 36.
CH2= CH-CH2-CH2-C = CH, कार्बनिक यौगिक में C2—C3 आबन्ध किन संकरित कक्षकों के युग्म से निर्मित होता है?
(क) sp-sp2
(ख) sp-sp3
(ग) sp2 -sp3
(घ) sp2 -sp3
उत्तर :
(ग) sp2 -sp3
प्रश्न 37.
किसी कार्बनिक यौगिक में लैंसे-परीक्षण द्वारा नाइट्रोजन की जाँच में प्रशियन ब्लू रंग निम्नलिखित में से किसके कारण प्राप्त होता है?
(क) Na4 [Fe(CN)6l
(ख) Fe4[Fe(CN)6l3
(ग) Fe2[Fe(CN)6)
(घ) Fe3[Fe(CN)6l4
उत्तर :
(ख) Fe4 [Fe(CN)6l3
प्रश्न 38.
निम्नलिखित कार्बधनायनों में से कौन-सा सबसे अधिक स्थायी है?
उत्तर :
प्रश्न 39.
कार्बनिक यौगिकों के पृथक्करण और शोधन की सर्वोत्तम तथा आधुनिकतम तकनीक कौन-सी है?
(क) क्रिस्टलन
(ख) आसवन
(ग) ऊर्ध्वपातन
(घ) क्रोमैटोग्रैफी
उत्तर :
(घ) क्रोमैटोग्रॅफी।
प्रश्न 40.
CH3CH2I+ ROH(aq) → CH2CH2OH+ KI अभिक्रिया को नीचे दिए गए प्रकार में वर्गीकृत कीजिए
(क) इलेक्ट्रॉनस्नेही प्रतिस्थापन
(ख) नाभिकस्नेही प्रतिस्थापन
(ग) विलोपन
(घ) संकलन
उत्तर :
(ख) नाभिकस्नेही प्रतिस्थापन
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
CH3-CH (CH3)-CO-CH2-CH2OH का IUPAC नाम है।
(i) 1 हाइड्रॉक्सी-4 मेथिल-3 पेन्टेनॉन
(ii) 2 मेथिल-5 हाइड्रॉक्सी -3 पेन्टेनॉन
(iii) 4 मेथिल-3 ऑक्सी-1 पेन्टेनॉल
(iv) 1-हेक्सेनॉल-3 ऑन
उत्तर :
(i) 1 हाइड्रॉक्सी-4 मेथिल-3 पेन्टेनॉन
प्रश्न 2.
निम्न में CH3OC2H5 का कौन-सा IUPAC नाम सही है ?
(i) एथिल मेथिल ईथर
(ii) मेथिल एथिल ईथर
(iii) मेथॉक्सी एथेन
(iv) एथॉक्सी मेथेन
उत्तर :
(iii) मेथॉक्सी एथेन
प्रश्न 3.
(i) 2, 3, 3, 4, 5 पेन्टामेथिल पेन्टेन
(ii) 2,3, 3, 4 ट्रेटामेथिल हेक्सेन
(iii) 1,2,3, 3, 4 पेन्टामेथिल पेन्टेन
(iv) 4 एथिल, 2, 3, 4 ट्राइमेथिल ब्यूटेन
उत्तर :
(ii) 2, 3,3,4 ट्रेटामेथिल हेक्सेन
प्रश्न 4.
CH2 = CH—CH(CH3)2 यौगिक का आई० पू० पी० ए० सी० पद्धति में नाम है।
(i) 1, 1 डाइमेथिल-2 प्रोपीन
(ii) 3,3 डाइमेथिल-1-प्रोपीन
(iii) 3-मेथिल-1-ब्यूटीन
(iv) 1 आइसोप्रोपिल एथिलीन
उत्तर :
(ii) 3 मेथिल-1-ब्यूटीन
प्रश्न 5.
लैक्टिक अम्ल का आई० पू० पी० ए० सी० नाम है।
(i) 2 हाइड्रॉक्सी-3 प्रोपेनॉइक अम्ल
(ii) 1 कार्बोक्सी-2 हाइड्रॉक्सी प्रोपेन
(iii) 2 हाइड्रॉक्सी प्रोपेनॉइक अम्ल
(iv) 1 कार्बोक्सी एथेनॉल
उत्तर :
(iii) 2 हाइड्रॉक्सी प्रोपेनॉइक अम्ल
प्रश्न 6.
निम्नलिखित में सर्वाधिक स्थायी कार्बोधनायन है।
(i) एथिल कार्बोधनायन
(ii) प्राथमिक कार्योधनायन
(iii) द्वितीयक कार्बाधिनायन
(iv) तृतीयक कार्बोधनायन
उत्तर :
(iv) तृतीयक कार्बोधनायन
प्रश्न 7.
ऋण आवेशित कार्बन वाले कार्बनिक समूह को कहते हैं।
(i) मुक्त मूलक
(ii) कार्बन आयन
(iii) लूइस अम्ल
(iv) कार्बोनियम आयन
उत्तर :
(ii) कार्बन आयन
प्रश्न 8.
निम्न में से कौन-सा कार्ब-एनायन सबसे अधिक स्थायी है ?
उत्तर :
प्रश्न 9.
मुक्त मूलक का लक्षण नहीं होता है।
(i) विद्युत उदासीनता ।
(ii) अनुचुम्बकीय गुण
(iii) अयुग्मित इलेक्ट्रॉन की उपस्थिति
(iv) हेटरोलिटिक विदलन से बनता है।
उत्तर :
(iv) हेटरोलिटिक विदलन से बनता है।
प्रश्न 10.
मेथेन का सूर्य के प्रकाश में क्लोरीनीकरण है।
(i) नाभिकस्नेही प्रतिस्थापन
(ii) इलेक्ट्रॉनस्नेही प्रतिस्थापन
(iii) मुक्त मूलक प्रतिस्थापन
(iv) इनमें से कोई नहीं
उत्तर :
(iii) मुक्त मूलक प्रतिस्थापन
प्रश्न 11.
निम्नलिखित में नाभिकस्नेही अभिकर्मक है।
(i) लूइस अम्ल
(ii) लूइस क्षार
(iii) मुक्त मूलक
(iv) इनमें से कोई नहीं
उत्तर :
(ii) लूइस क्षार
प्रश्न 12.
निम्नलिखित में नाभिकस्नेही अभिकर्मक है।
(i) R2N
(ii) SO3
(iii) BF2
(iv) NO+2
उत्तर :
(i) R3N
प्रश्न 13.
निम्नलिखित में नाभिकस्नेही अभिकर्मक नहीं है।
(i) NH3
(ii) AlCl3
(iii) H2O
(iv) Cl–
उत्तर :
(ii) AlCl3
प्रश्न 14.
(i) इलेक्ट्रॉनस्नेही प्रतिस्थापन
(ii) इलेक्ट्रॉनस्नेही योगात्मक
(iii) नाभिकस्नेहीं योगात्मक
(iv) नाभिकस्नेही प्रतिस्थापन
उत्तर :
(iii) नाभिकस्नेही योगात्मक
प्रश्न 15.
निम्नलिखित में इलेक्ट्रॉनस्नेही अभिकर्मक है।
(i) BF3
(ii) NH3
(iii) H2O
(iv) R — OH
उत्तर :
(i) BF3
प्रश्न 16.
ऐल्कीन में हैलोजन अम्ल का योग है।
(i) न्यूक्लियोफिलिक योग
(ii) इलेक्ट्रोफिलिक योग
(iii) मुक्त मूलक
(iv) इनमें से कोई नहीं
उत्तर :
(ii) इलेक्ट्रोफिलिक योग
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
खुली श्रृंखला यौगिक अथवा अचक्रीय यौगिक अथवा ऐलिफैटिक यौगिक क्या हैं? उदाहरण भी दीजिए।
उत्तर :
जिन कार्बनिक यौगिकों में कार्बन परमाणुओं की खुली श्रृंखला होती है, खुली श्रृंखला यौगिक अथवा अचक्रीय यौगिक कहलाते हैं। इन यौगिकों को ऐलिफैटिक यौगिक भी कहते हैं।
उदाहरणार्थ-
प्रश्न 2.
बन्द श्रृंखला यौगिक अथवा चक्रीय यौगिक की परिभाषा उदाहरण सहित दीजिए।
उत्तर :
जिन कार्बनिक यौगिकों में परमाणुओं की एक या उससे अधिक बन्द श्रृंखलाएँ अथवा वलय होते हैं, बन्द श्रृंखला यौगिक अथवा चक्रीय यौगिक कहलाते हैं।
उदाहरणार्थ-
प्रश्न 3.
समचक्रीय तथा विषमचक्रीय यौगिक क्या होते हैं? प्रत्येक के दो-दो उदाहरण भी दीजिए।
उत्तर :
समचक्रीय यौगिक-वे यौगिक जिनमें वलय केवल कार्बन परमाणुओं का बना होता है, समुचक्रीय यौगिक कहलाते हैं। उदाहरणार्थ-साइक्लोप्रोपेन, डाइफेनिल, बेंजीन, टॉलूईन आदि।। विषमचक्रीय यौगिक-वे बन्द श्रृंखला यौगिक जिनकी वलय में विषम परमाणु (कार्बन तथा हाइड्रोजन के अतिरिक्त अन्य परमाणु, जैसे–N, O, s आदि) होते हैं, विषमचक्रीय यौगिक कहलाते हैं।
उदाहरणार्थ–फ्यूरेन, थायोफीन, पिरीडीन आदि।
प्रश्न 4.
ऐलिसाइक्लिक यौगिक क्या हैं? उदाहरण भी दीजिए।
उत्तर :
वे समचक्रीय यौगिक जिनके गुण ऐलिफैटिक यौगिकों के गुणों से मिलते-जुलते होते हैं, ऐलिसाइक्लिक यौगिक कहलाते हैं।
उदाहरणार्थ-
प्रश्न 5.
ऐरोमैटिक यौगिक क्या हैं? उदाहरण भी दीजिए।
उत्तर :
ये विशेष प्रकार के चक्रीय असंतृप्त यौगिक हैं। इन यौगिकों के लिए ऐरोमैटिक शब्द का प्रयोग प्रारम्भ में खोजे गये कुछ यौगिकों की मीठी गन्धं होने के कारण किया गया था परन्तु अब दुर्गन्धयुक्त ऐरोमैटिक भी ज्ञात हैं।
उदाहरणार्थ-
प्रश्न 6.
क्रियात्मक समूह से क्या तात्पर्य है?
उत्तर :
किसी अणु में उपस्थित परमाणु अथवा परमाणुओं का समूह, जो मुख्य रूप से उसके रासायनिक गुण निर्धारित करता है, क्रियात्मक समूह कहलाता है।
प्रश्न 7.
ऐल्डिहाइड यौगिक में कौन-सा क्रियात्मक समूह होता है?
उत्तर :
ऐल्डिहाइड यौगिक में —CHO क्रियात्मक समूह होता है।
प्रश्न 8.
IUPAC नामकरण पद्धति में प्राथमिक अनुलग्न क्या दर्शाता है।
उत्तर :
IUPAC नामकरण पद्धति में प्राथमिक अनुलग्न दर्शाता है कि कार्बन श्रृंखला संतृप्त है अथवा असंतृप्त।
प्रश्न 9.
निम्नलिखित यौगिकों के IUPAC नाम लिखिए
उत्तर :
(i) N, N-डाइमेथिल-2-मेथिल प्रोपेनाइन
(ii) आइसोप्रोप्रिल प्रोपोनेट
(iii) 3-मेथिल पेन्टानोइक ऐसिड
(iv) 2, 4-डाइमेथिल हेक्सेन
(v) हेप्ट-5-ईन-3-आइन, 2-ओन
(vi) 3-ब्रोमो, 2-क्लोरो, 4-आयोडो हेक्सेन
(vii) हाइड्रॉक्सी 2-फेनिल प्रोपेनोइक ऐसिड
(viii) 2-ब्रोमो, एथिल प्रोपानोएट
(ix) N मेथिल 2-प्रोपेनामीन
(x) प्रोपेन 1, 2, 3-ट्राइकार्बोनाइट्राइल
(xi) 3-ब्रोमो, 3-क्लोरो, 2-मेथिल ब्यूटेनोइक ऐसिड
(xii) 4-हाइड्रॉक्सी 4-मेथिल, पेन्टेनोन-2
प्रश्न 10.
IUPAC पद्धति में निम्नलिखित संरचना सूत्र वाले यौगिकों का नाम बताइए
उत्तर :
(i) ब्यूट-3-ईन-1-आइन
(ii) पेन्ट-3-ईन-1-आइन
(iii) 2, 2, 3-ट्राइक्लोरो ब्यूटेन-1 ऑल
(iv) 2-मेथिल 1, 4-हेक्सेन-डाई-ऑल।
(v) 2-हाइड्रॉक्सी ब्यूटेन-1 ऑल
(vi) 2-एथिल-4-मेथिल हेक्सेन
(vii) 2-ब्यूटेनल
(viii) 2-प्रोपेनल
(ix) 3-मेथिल-पेन्टेन-2 ऑन
(x) हाइड्रॉक्सी ब्यूटेनोइक अम्ल
(xi) प्रोपेनॉइल क्लोराइड
(xii) 3-मेथिल ब्यूटेनॉइल क्लोराइड
प्रश्न 11.
समतल ध्रुवित प्रकाश किसे कहते हैं? यह कैसे प्राप्त किया जाता है?
उत्तर :
वह प्रकाश जिसमें कम्पन केवल एक ही तल में होते हैं, समतल ध्रुवित प्रकाश कहलाता है। साधारण प्रकाश की किरण को निकोल प्रिज्म में से प्रवाहित करने पर वह समतल ध्रुवित प्रकाश में परिवर्तित हो जाता है।
प्रश्न 12.
ध्रुवण घूर्णकता क्या है?
उत्तर :
कुछ पदार्थों में क्रिस्टलीय अवस्था या विलयन अवस्था में समतल ध्रुवित प्रकाश के तल को दायीं ओर या बायीं ओर घुमाने का गुण होता है। पदार्थों के इस गुण की ध्रुवण घूर्णकता कहते हैं। उदाहरणार्थ-लैक्टिक अम्ल, टार्टरिक अम्ल, ग्लूकोस आदि।
प्रश्न 13.
किरेल एवं अकिरेल अणु क्या होते हैं?
उत्तर :
जो अणु दायें ओर बायें हाथों की भाँति अपने दर्पण प्रतिबिम्ब पर अध्यारोपित नहीं होते हैं वे किरेल अणु कहलाते है। उदाहरणार्थ-2-ब्यूटेनॉल अणु। जबकि जो अणु दायें और बायें हाथों की भॉति अपने दर्पण प्रतिबिम्ब पर अध्यारोपित होते हैं, वे अकिरेल अणु कहलाते हैं। उदाहरणार्थ-1-ब्यूटेनॉल अणु।।
प्रश्न 14.
असममित कार्बन परमाणु क्या है?
उत्तर :
किसी अणु में जो चतुष्फलकीय कार्बन परमाणु चार भिन्न परमाणुओं या समूहों से जुड़ा होता है, असममित कार्बन परमाणु कहलाता है।
प्रश्न 15.
कार्बोनियम आयन को उदाहरण सहित समझाइए। इसके दो गुण लिखिए।
उत्तर :
वह धनावेशित आयन जिसमें कार्बन परमाणु पर धनावेश होता है तथा धनावेशित कार्बन परमाणु के संयोजी कोश में केवल 6 इलेक्ट्रॉन होते हैं, कार्बोधनायन या कार्बोनियम आयन कहलाता है।
उदाहरणार्थ-
कार्बोनियन आयन के दो प्रमुख गुण निम्नलिखित हैं-
- इनका अष्टक अपूर्ण होता है।
- ये धनावेशित होते हैं। अत: इनकी प्रकृति इलेक्ट्रॉनस्नेही होती है।
प्रश्न 16.
कार्बनायन किसे कहते हैं? कार्बनायन की दो विशेषताएँ लिखिए। किसी एक कार्बनायन का सूत्र भी लिखिए।
उत्तर :
वह ऋणावेशित आयन जिसमें कार्बन परमाणु पर ऋणावेश होता है तथा ऋणावेशित कार्बन के पास एक एकाकी इलेक्ट्रॉन युग्म होता है, कार्बनायन कहलाता है।
उदाहरणार्थ-
कार्बनायनों की दो प्रमुख विशेषताएँ निम्न हैं-
- ऋणावेशित कार्बन के पास एक-एकाकी इलेक्ट्रॉन युग्म होता है।
- इनका निर्माण विषमांगी (हेटरोलिटिक) विदलन से होता है।
प्रश्न 17.
मुक्त मूलक क्या होते हैं? ये किस प्रकार बनते हैं?
उत्तर :
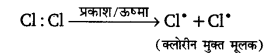
उदासीन परमाणु या परमाणुओं का समूह जिसके पास विषम या अयुग्मित इलेक्ट्रॉन होता है, मुक्त मूलक (free radical) कहलाता है। मुक्त मूलक के प्रतीक अथवा सूत्र में अयुग्मित इलेक्ट्रॉन को एक बिन्दु द्वारा प्रदर्शित करते हैं।’ जैसेजैसे— क्लोरीन मुक्त मूलक को प्रदर्शित करता है। मुक्त मूलक बहुत अस्थायी और बहुत क्रियाशील होते हैं। मुक्त मूलक सह-संयोजी बन्ध में होमोलिटिक विदलन से उत्पन्न होता है। जैसे—क्लोरीन अणु को मुक्त मूलकों में विखण्डन सूर्य के प्रकाश या ऊष्मा द्वारा होता है।
क्लोरीन मुक्त मूलक को प्रदर्शित करता है। मुक्त मूलक बहुत अस्थायी और बहुत क्रियाशील होते हैं। मुक्त मूलक सह-संयोजी बन्ध में होमोलिटिक विदलन से उत्पन्न होता है। जैसे—क्लोरीन अणु को मुक्त मूलकों में विखण्डन सूर्य के प्रकाश या ऊष्मा द्वारा होता है।
प्रश्न 18.
आयम तथा मुक्त मूलक में क्या अन्तर है?
उत्तर :
आयन तथा मुक्त मूलक में प्रमुख अन्तर इस प्रकार हैं-
प्रश्न 19.
प्रेरणिक प्रभाव व इलेक्ट्रोमेरिक प्रभाव में अन्तर लिखिए।
उत्तर :
प्रेरणिक प्रभाव व इलेक्ट्रोमेरिक प्रभाव में निम्नलिखित अन्तर हैं-
प्रश्न 20.
नाभिकस्नेही प्रतिस्थापन अभिक्रिया को उदाहरण सहित समझाइए।
उत्तर :
यदि प्रतिस्थापन अभिक्रिया नाभिकस्नेही अभिकर्मक द्वारा सम्पन्न होती है तो उसे नाभिकस्नेही । प्रतिस्थापन अभिक्रिया कहते हैं। इसे SN द्वारा प्रकट करते हैं। ऐल्किल हैलाइंडों की प्रतिस्थापन अभिक्रियाएँ नाभिकस्नेही अभिक्रियाएँ होती हैं।
उदाहरणार्थ-ऐल्किल हैलाइड का जलीय क्षारक द्वारा जल-अपघटन
प्रश्न 21.
SN1 अभिक्रिया से क्या अभिप्राय है? उदाहरण सहित समझाइए।
उत्तर :
इस अभिक्रिया में आक्रमणकारी अभिकर्मक नाभिकस्नेही जैसे–OH– ,CN– आदि होते हैं। इन अभिक्रियाओं की दर केवल एक स्पीशीज के सान्द्रण पर निर्भर करती है अतः इन अभिक्रियाओं को SM1 से प्रदर्शित करते हैं।
उदाहरण—-ब्यूटिल क्लोराइड की जल तथा ऐसीटोन के मिश्रण में सोडियम हाइड्रॉक्साइड से अभिक्रिया द्वारा 1-ब्यूटिल ऐल्कोहॉल बनता है।
प्रश्न 22.
मुक्त मूलक प्रतिस्थापन अभिक्रिया को उदाहरण सहित समझाइए।
उत्तर :
यदि प्रतिस्थापन अभिक्रिया मुक्त मूलक अभिकर्मक द्वारा सम्पन्न होती है तो उसे मुक्त मूलक प्रतिस्थापन अभिक्रिया कहते हैं।
उदाहरणार्थ-विसरित प्रकाश में मेथेन तथा क्लोरीन की अभिक्रिया
इस अभिक्रिया में आक्रमणकारी अभिकर्मक एक मुक्त मूलक (Cl·) होता है।
प्रश्न 23.
योगात्मक या संकलन अभिक्रियाएँ क्या हैं?
उत्तर :
वे अभिक्रियाएँ जिनमें दो अणु संयोग करके एक अणु बनाते हैं योगात्मक या संकलन अभिक्रियाएँ कहलाती हैं। ये अभिक्रियाएँ सामान्यत: बहुआबन्ध युक्त कार्बनिक यौगिकों में होती हैं। इन अभिक्रियाओं में एक π – आबन्धका विदलन हो जाता है तथा दो σ -आबन्ध बनते हैं।
उदाहरणार्थ-
लघु उत्तरीय प्रश्न
प्रश्न 1.
समावयवता किसे कहते हैं? उदाहरण सहित वर्णन कीजिए।
उत्तर :
जिन यौगिकों के अणुसूत्र समान होते हैं परन्तु गुण भिन्न-भिन्न होते हैं समावयवी कहलाते हैं। तथा यह परिघटना समावयवता कहलाती है। उदाहरणार्थ-एथिल ऐल्कोहॉल और डाइमेथिल ईथर दोनों समावयवी हैं।
प्रश्न 2.
संरचनात्मक समावयवता को परिभाषित कीजिए इसके प्रकार भी लिखिए।
उत्तर :
संरचनात्मक समावयवता अणुओं के संरचना सूत्रों में भिन्नता होने के कारण उत्पन्न होती है। संरचनात्मक समावयवियों के अणुसूत्र तो समान होते हैं परन्तु उनके संरचना सूत्र भिन्न-भिन्न होते हैं। संरचनात्मक समावयवता के प्रमुख प्रकार निम्नवत् हैं-
- श्रृंखला समावयवता,
- स्थाने समावयवता,
- क्रियात्मक समूह समावयवता,
- मध्यावयवता तथा
- चलावयवता
प्रश्न 3.
श्रृंखला समावयवता का उदाहरण सहित वर्णन कीजिए।
उत्तर :
श्रृंखला समावयवता अणुओं के कार्बन श्रृंखला की रचना में भिन्नता होने के कारण उत्पन्न होती है। श्रृंखला समावयवियों के अणुसूत्र तो समान होते हैं, परन्तु उनकी कार्बन श्रृंखलाओं की रचना में भिन्नता होती है। श्रृंखला समावयवी समान सजातीय श्रेणी के सदस्य होते हैं।
उदाहरणार्थ-
ब्यूटेन के दो श्रृंखला समावयवी हैं जिनके संरचना सूत्र निम्नवत् हैं-
प्रश्न 4.
स्थान समावयवता को परिभाषित कीजिए।
उत्तर :
स्थान समावयवता कार्बन श्रृंखला में किसी प्रतिस्थापी समूह या युग्म बन्ध के स्थान में भिन्नता होने के कारण उत्पन्न होती है। स्थान समावयवियों के अणुसूत्र एवं कार्बन श्रृंखला की रचना तो समान होती है परन्तु उनकी कार्बन श्रृंखला में प्रतिस्थापी समूह या युग्म बन्ध का स्थान भिन्न होता है। स्थान समावयवी भी सजातीय श्रेणी के सदस्य होते हैं।
उदाहरणार्थ- 1-ब्यूटीन और 2-ब्यूटीन, ब्यूटीन के दो स्थान समावयवी हैं।
प्रश्न 5.
क्रियात्मक समूह समावयवता को उदाहरण सहित समझाइए।
उत्तर :
क्रियात्मक समूह समावयवता अणुओं में भिन्न क्रियात्मक समूहों की उपस्थिति के कारण होती है। क्रियात्मक समूह समावयवियों के अणुसूत्र तो समान होते हैं परन्तु उनमें क्रियात्मक समूह भिन्न-भिन्न होते हैं। क्रियात्मक समूह समावयवी भिन्न-भिन्न सजातीय श्रेणियों के यौगिक होते हैं।
उदाहरणार्थ-एथिल ऐल्कोहॉल तथा डाइमेथिल ईथर क्रियात्मक समूह समावयवी हैं।
प्रश्न 6.
मध्यावयवता को परिभाषित कीजिए।
उत्तर :
मध्यावयवता किसी द्वि-संयोजी क्रियात्मक समूह से जुड़े ऐल्किल समूहों की प्रकृति में भिन्नता होने के कारण उत्पन्न होती है। मध्यावयवियों के अणुसूत्र तो समान होते हैं परन्तु उनमें द्वि-संयोजी क्रियात्मक समूह में जुड़े ऐल्किल समूहों की प्रकृति भिन्न-भिन्न होती है। मध्यावयवी एक ही सजातीय श्रेणी के सदस्य होते हैं। ईथर, ऐल्किल सल्फाइड, द्वितीयक ऐमीन, एस्टर आदि मध्यावयवता प्रदर्शित करते हैं।
उदाहरणार्थ-डाइएथिले सल्फाइड एवं मेथिल-n-प्रोपिल सल्फाइड मध्यावयवी हैं।
प्रश्न 7.
चयावयवता का वर्णन कीजिए।
उत्तर :
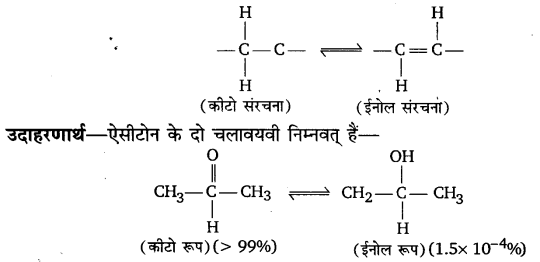
यह एक विशेष प्रकार की संरचनात्मक समावयवता है जिनमें दो संरचनात्मक समावयवी सरलता से एक-दूसरे में परिवर्तित हो जाते हैं तथा समावयवियों के मध्य साम्यावस्था विद्यमान होती है। वह परिघटना जिसमें दो संरचना समावयवी सरलता में एक-दूसरे में परिवर्तित हो जाते हैं और परस्पर साम्यवस्था में रहते हैं चलावयव या चलावयवी रूप कहलाते हैं।
यौगिक विभिन्न प्रकार की चलावयवता प्रदर्शित करते हैं जिनमें कीटो-ईनोल चलावयवता प्रमुख है। ऐल्डिहाइड और कीटोन जिनमें कार्बोनिल समूह के निकटवर्ती कार्बन परमाणु पर एक या अधिक हाइड्रोजन परमाणु उपस्थित होते हैं। कीटो-ईनोल चलावयवता प्रदर्शित करते हैं। कीटो-ईनोल चलावयवता -हाइड्रोजन परमाणु का निकटवर्ती कार्बोनिल समूह के ऑक्सीजन परमाणु पर अभिगमन होने में उत्पन्न होती है।
प्रश्न 8.
त्रिविम समावयवती को उदाहरण सहित समझाइए।
उत्तर :
जब अणुओं में अनके परमाणुओं की आकाशीय व्यवस्था (विन्यास) में भिन्नता होती है तो यह परिघटना त्रिविम समावयवता कहलाती है। त्रिविम समावयवियों के अणुसूत्र एवं संरचना सूत्र तो समान होते हैं परन्तु उनके परमाणुओं की आकाशीय व्यवस्था भिन्न-भिन्न होती है।
उदाहरणार्थ-2-ब्यूटीन की निम्नलिखित दो त्रिविम संरचनाएँ सम्भव हैं|
प्रश्न 9.
त्रिविम समावयवियों के प्रकार बताइए।
उत्तर :
त्रिविम समावयवी मुख्य रूप से दो प्रकार के होते हैं-
- प्रतिबिम्ब रूप तथा
- अप्रतिबिम्बी त्रिविम समावयव
जो त्रिविम समावयवी बायें एवं दायें हाथों के सदृश एक-दूसरे के अन-अध्यारोपणीय दर्पण प्रतिबिम्ब रूप कहलाते हैं जबकि जो त्रिविम समावयवी एक-दूसरे के दर्पण प्रतिबिम्ब नहीं होते हैं, वे अप्रतिबिम्बी त्रिविम समावयवी कहलाते हैं।
प्रश्न 10.
ज्यामितीय समावयवता को उदाहरण सहित समझाइए।
उत्तर :
प्राय: कार्बन-कार्बन युग्म बन्ध युक्त वे यौगिक जिनमें युग्म-बन्धित कार्बन परमाणु में जुड़े दो परमाणु या समूह भिन्न प्रकार के होते हैं, ज्यामितीय समावयवता प्रदर्शित करते हैं, यह समावयवता युग्म बन्ध के चारों ओर सीमित घूर्णन के कारण उत्पन्न होती है।
उदाहरणार्थ-2-ब्यूटीन की। निम्नलिखित दो त्रिविम संरचनाएँ सम्भव हैं-
ये दो त्रिविम संरचनाएँ (I एवं II) 2-ब्यूटीन के दो ज्यामितीय समावयवियों को प्रदर्शित करती हैं जो सिस-ट्रान्स समावयवी कहलाते हैं। जिन ज्यामितीय समावयवी में समान समूह एक ही पथ में होते हैं। उसे cis-समावयवी या समकक्ष रूप और जिनमें समान विपरीत पक्षों में होते हैं उसे trans-समावयवी या विपक्ष रूप कहते हैं।
प्रश्न 11.
प्रकाशिक समावयवता को उदाहरण सहित स्पष्ट कीजिए।
उत्तर :
प्रकाशिक समावयवता एक प्रकार की त्रिविम समावयवता है तो उन कार्बनिक यौगिकों द्वारा दर्शायी जाती है जिनके अणु विसममित अर्थात् किरेल होते हैं। प्रकाशिक समावयवी समतल ध्रुवित प्रकाश के प्रति भिन्न व्यवहार प्रदर्शित करते हैं जो त्रिविम समावयवी ध्रुवित प्रकाश के तल को दक्षिणावर्त घुमाता है उसे दक्षिण ध्रुवण-घूर्णक ओर जो त्रिविम समावयवी ध्रुवित प्रकाश के तल को वामावर्त घुमाता है उसे वाम ध्रुवण-घूर्णक कहते हैं। ध्रुवण अघूर्णक प्रकाशिक समावयवी मेसो समावयवी कहलाते हैं। मेसो समावयवियों के अणु सममित होते हैं। प्रकाशिक समावयवियों के रासायनिक गुण में तो समानता होती है परन्तु उनके भौतिक गुण समान या भिन्न हो सकते हैं।
उदाहरणार्थ-लैक्टिक अम्ल की प्रकाशिक समावयवता
प्रश्न 12.
एक यौगिक का सूत्र CH2OH—CHCl—CHOH—CHOH—CHCl—CH2OH है। यौगिक के प्रकाशिक संमावयवियों की गणना कीजिए।
उत्तर :
यौगिक CH2OH—CHCl—CHOH—CHOH—CHCl—CH2OH के अणु में असममित कार्बन परमाणुओं की संख्या (n) चार है।
यौगिक के अणु को एक जैसे दो बराबर भागों में विभाजित किया जा सकता है तथा अणु में असममित परमाणुओं की संख्या सम (even) है। अतः ऐसी स्थिति में यौगिक के,
ध्रुवण-घूर्णक समावयवियों की संख्या, a = 2(n-1) = 2(4-1) = 8
मेसो-समावयवियों की संख्या, m=2(n/2-1) = 2(2-1) =2
और प्रकाशिक समावयवियों की संख्या = a+m= 8+2= 10
प्रश्न 13.
होमोलिटिक तथा हेटरोलिटिक विदलन को एक उदाहरण सहित समझाइए।
उत्तर :
एक सह-संयोजी बन्ध दो परमाणुओं के मध्य इलेक्ट्रॉन युग्म की साझेदारी द्वारा बनता है। इस प्रकार संयुक्त दो परमाणुओं को एक-दूसरे से अलग होना बन्ध का विदलन या विखण्डन कहलाता है।
(i) होमोलिटिक विदलन या समांग विखण्डन—यह वह प्रक्रम है जिसमें पृथक् होने वाली प्रत्येक परमाणु सह-संयोजी बन्ध के इलेक्ट्रॉन युग्म से एक इलेक्ट्रॉन लेकर पृथक् होता है। इस विदलन द्वारा उत्पन्न खण्डों के पास सह-संयोजक बन्ध का एक-एक इलेक्ट्रॉन होता है। इन खण्डों को मुक्त मूलक कहते हैं।
उदाहरणार्थ-
(ii) हेटरोलिटिक विदलन या विषमांग विखण्डन-इस विदलन में बन्ध के साझे का इलेक्ट्रॉन युग्म । किसी भी परमाणु या खण्ड के साथ चला जाता है और दो आयन बनते हैं।
जब R+ एक ऐसा समूह होता है जिसके कार्बन परमाणु पर धनावेश होता है तो इसे कार्बोनियम आयनं कहते हैं तथा जब R– के कार्बन परमाणु पर ऋणावेश होता है तो इसे कार्बनायन कहते हैं।
प्रश्न 14.
अनुनाद पर संक्षिप्त टिप्पणी लिखिए।
उत्तर :
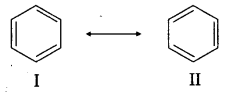
ऐसे अनेक कार्बनिक यौगिक ज्ञात हैं जिनके सभी गुणों को केवल एक लूईस संरचना (Lewis structure) द्वारा पूर्णतः प्रदर्शित नहीं किया जा सकता है। ऐसे में यौगिक के अणु को अनेक ऐसी संरचनाओं द्वारा प्रदर्शित किया जाता है जिनमें से प्रत्येक अणु के अधिकांश गुणों की व्याख्या करती है, परन्तु कोई भी अणु के सभी गुणों की व्याख्या नहीं करती है। ऐसे में अणु की वास्तविक संरचना इन सभी योगदान करने वाली संरचनाओं (जिन्हें अनुनाद संरचनाएँ या विहित संरचनाएँ कहते हैं) की मध्यवर्ती होती है तथा इसे सभी लूईस संरचनाओं का अनुनाद संकर (resonance hybrid) कहते हैं। इस परिघटना को अनुनाद या मीसोमेरिकता कहते हैं।
वास्तव में अनुनाद संरचनाओं या विहित संरचनाओं (canonical structures) का कोई अस्तित्व नहीं है। वास्तव में अणु की केवल एक ही संरचना होती है जो कि विभिन्न विहित संरचनाओं का अनुनाद संकर होता है तथा इसे एक लूईस संरचना द्वारा प्रदर्शित नहीं किया जा सकता है। किसी अणु की विभिन्न संरचनाओं को चिह्न (+) द्वारा पृथक् करके लिखा जाता है। बेंजीन भी एक ऐसा ही यौगिक है जिसके व्यवहार को केवल एक लूईस संरचना द्वारा समझाया नहीं जा सकता है। बेंजीन को निम्न दो अनुनादी संरचनाओं का अनुनाद संकर माना जाता है।
प्रश्न 15.
अनुनाद प्रभाव या मीसोमेरिक प्रभाव को समझाइए।
उत्तर :
संयुग्मित निकायों (जिनमें एकान्तर से एकल और द्विआबन्ध होते हैं) में अनुनाद के कारण निकाय के एक भाग से दूसरे भाग में इलेक्ट्रॉनों का विस्थापन होता है जिसके कारण उच्च तथा निम्न इलेक्ट्रॉन घनत्व के केन्द्र बन जाते हैं। यह प्रभाव अनुनाद प्रभाव अथवा मीसोमेरिक प्रभाव कहलाता है। यह दो प्रकार का होता है।
1. धनात्मक अनुनाद प्रभाव—यह प्रभाव उन समूहों द्वारा दर्शाया जाता है जो द्विआबन्ध अथवा एक संयुग्मित निकाय को इलेक्ट्रॉन दान देते हैं। —Cl,—Br,I,-NH2,-NR2,–OH,-OR,-SH-SR आदि ऐसे समूहों के उदाहरण हैं।
2. ऋणात्मकं अनुनाद प्रभाव—यह प्रभाव उन समूहों द्वारा दर्शाया जाता है जो द्विआबन्ध या संयुग्मित निकाय से इलेक्ट्रॉन अपनी ओर विस्थापित करते हैं।
प्रश्न 16.
अतिसंयुग्मन प्रभाव पर एक टिप्पणी लिखिए।
उत्तर :
संतृप्त निकाय पर ऐल्किल समूहों के प्रेरणिक प्रभाव का क्रम निम्न होता है
(CH3 )3 C—(CH3)2CH—>CH3CH2–>CH3–
परन्तु जब ऐल्किल समूह किसी असंतृप्त निकाय से जुड़ा होता है तो प्रेरणिक प्रभाव का क्रम उल्टा हो । जाता है। यह प्रभावं अतिसंयुग्मन प्रभाव कहलाता है। चूंकि इस प्रभाव को सर्वप्रथम बेकर तथा नाथन ने देखा इसलिए इस प्रभाव को बेकर-नाथन प्रभाव भी कहते हैं।
अतिसंयुग्मन में द्विआबन्ध के p-कक्षकों तथा समीपवर्ती एकल आबन्ध के 6–कक्षक के अतिव्यापन के द्वारा 5-इलेक्ट्रॉनों का विस्थानीकरण होता है। अत: इसमें -7 संयुग्मन (G-I conjugation) होता है। वास्तव में अतिसंयुग्मन प्रभाव अनुनाद प्रभाव का ही विस्तार है। चूंकि अतिसंयुग्मन – H परमाणुओं के द्वारा होता है, इसलिए 0- H परमाणुओं की संख्या जितनी अधिक होती है, उतनी ही अधिक अतिसंयुग्मी संरचनाएँ होती हैं और प्रभाव भी उतना ही अधिक होता है। मेथिल समूह, एथिल समूह, आइसोप्रोपिल समूह तथा तृतीयक-ब्यूटिल समूह के साथ हाइड्रोजन परमाणुओं की संख्या क्रमशः 3, 2, 1 तथा 0 होती है अतः इन विभिन्न समूहों के लिए अतिसंयुग्मन प्रभाव का क्रम निम्न होता है-
प्रश्न 17.
इलेक्ट्रॉनस्नेही प्रतिस्थापन अभिक्रिया को उदाहरण सहित समझाइए।
उत्तर :
यदि प्रतिस्थापन अभिक्रिया इलेक्ट्रॉनस्नेही अभिकर्मक द्वारा सम्पन्न होती है तो उसे इलेक्ट्रॉनस्नेही प्रतिस्थापन अभिक्रिया कहते हैं। इसे SE (S = substitution तथा E= electrophilic) से प्रकट करते हैं तथा SE1 और SE2 में 1 तथा 2 कोटि को प्रकट करते हैं। ऐरोमैटिक प्रतिस्थापन; जैसे-हैलोजनीकरण, नाइट्रीकरण तथा सल्फोनीकरण SE 2 प्रकार के इलेक्ट्रोफिलिक (इलेक्ट्रॉनस्नेही) प्रतिस्थापन हैं।
उदाहरणार्थ-
प्रश्न 18.
ऐल्काइनों की हाइड्रोजन हैलाइडों से योग क्रिया किस प्रकार की अभिक्रिया है ? इसकी क्रियाविधि समझाइए।
या
इलेक्ट्रॉनस्नेही योगात्मक अभिक्रिया को उदाहरण देते हुए समझाइए।
उत्तर :
यदि योगात्मक अभिक्रिया इलेक्ट्रॉनस्नेही अभिकर्मक द्वारा सम्पन्न होती है तो उसे इलेक्ट्रॉनस्नेही योगात्मक अभिक्रिया कहते हैं। प्रश्न में उल्लिखित अभिक्रिया भी एक इलेक्ट्रॉनस्नेही योगात्मक (संकलन) अभिक्रिया है। ऐल्कीनों में हाइड्रोजन हैलाइड का योग कार्बन-कार्बन युग्म बन्ध पर दो पदों में होता है। पहले पद में ऐल्किल हाइड्रोजन हैलाइड से प्रोटॉन H+ (इलेक्ट्रॉनस्नेही) ग्रहण करती है और कार्बोधनायन (मध्यवर्ती) तथा हैलाइड आयन बनाती है। दूसरे पद में कार्बोधनायन हैलाइड आयन से संयोग करता है और ऐल्किल हैलाइड बनाता है।
उदाहरणार्थ-एथिलीन में HBr का योग
प्रश्न 19.
नाभिकस्नेही योगात्मक अभिक्रिया का उदाहरण सहित उल्लेख कीजिए।
उत्तर :
यदि योगात्मक अभिक्रिया नाभिकस्नेही अभिकर्मक द्वारा सम्पन्न होती है तो उसे नाभिकस्नेही योगात्मक अभिक्रिया कहते हैं।
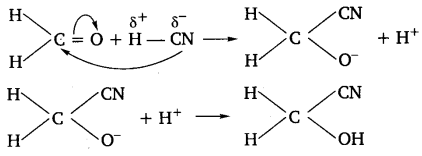
उदाहरणार्थ- मेथेनल (फॉर्मेल्डिहाइड) पर HCN का योग
ऐल्डिहाइड और कीटोन मुख्यत: इसी प्रकार की अभिक्रियाएँ करते हैं।
प्रश्न 20.
मुक्त मूलक योगात्मक अभिक्रिया को उदाहरण सहित समझाइए।
उत्तर :
यदि योगात्मक अभिक्रिया मुक्त मूलक अभिकर्मक द्वारा सम्पन्न होती है तो उसे मुक्त मूलक योगात्मक अभिक्रिया कहते हैं।
उदाहरणार्थ-परॉक्साइड की उपस्थिति में ऐल्कीनों पर HBr का योग।
प्रश्न 21.
किसी ऐल्किल हैलाइड के विहाइड्रोहैलोजनीकरण की अभिक्रिया की क्रिया-विधि समझाइए।
या
α-विलोपन अभिक्रियाएँ क्या हैं? उदाहरण दीजिए।
उत्तर :
जिन अभिक्रियाओं में परमाणुओं अथवा समूहों को विलोपन क्रियाधार अणु के एक ही परमाणु में होता है, वे α-विलोपन अभिक्रियाएँ कहलाती हैं। विहाइड्रोहैलोजनीकरण α-विलोपन अभिक्रिया का उदाहरण है। ऐल्किल हैलाइडों को ऐल्कोहॉलीय KOH के साथ उबालने पर ऐल्कीन प्राप्त होते हैं; जैसे- आइसोप्रोपिल ब्रोमाइड प्रोपीन देता है।
यह अभिक्रिया विहाइड्रोहैलोजनीकरण कहलाती है। इस अभिक्रिया में हाइड्रोजन एक कार्बन परमाणु से तथा हैलोजन निकटवर्ती दूसरे कार्बन परमाणु से HBr के रूप में विलोपित होता है। इस अभिक्रिया की क्रिया-विधि (SN 2) एक ही पद में निम्नलिखित प्रकार से व्यक्त की जाती है।
प्रश्न 22.
β-विलोपन अभिक्रियाएँ क्या होती हैं? उदाहरण सहित समझाइए।
या
निर्जलीकरण अभिक्रिया की क्रिया-विधि को उदाहरण सहित समझाइए।
उत्तर :
जिन अभिक्रियाओं में परमाणुओं या समूहों का विलोपन क्रियाधार अणु के समीपवर्ती परमाणुओं में होता है, वे β-विलोपन अभिक्रियाएँ कहलाती हैं।
उदाहरणार्थ-सान्द्र H2SO4, H3PO4 निर्जल ZnCl2 आदि निर्जलीकारक पदार्थ ऐल्कोहॉल का निर्जलीकरण करके ऐल्कीन बनाते हैं।
ऐल्कीन ऐल्कोहॉलों के निर्जलीकरण की क्रिया-विधि को निम्नलिखित पदों में प्रकट कर सकते हैं।
1. ऐल्कोहॉलों के –OH समूह में इलेक्ट्रॉन के दो एकाकी युग्म होते हैं। इनमें से एक युग्म प्रयुक्त अम्ल से एक प्रोटॉन ग्रहण करके प्रोटॉनयुक्त ऐल्कोहॉल या ऑक्सोनियम आयन बना लेता है।
2. ऑक्सोनियम आयन जल तथा कार्बोनियम आयन में विघटित हो जाता है।
3. कार्बोनियम आयन के कार्बन परमाणु पर केवल 6 इलेक्ट्रॉन होते हैं। इसलिए यह एक इलेक्ट्रॉन युग्म ग्रहण करने की प्रवृत्ति रखती है। इस स्थिति में पास का कार्बन परमाणु हाइड्रोजन आयन पृथक् करता है और ऐल्कीन अणु उत्पन्न होता है।
प्रश्न 23.
नाइट्रीकरण पर टिप्पणी लिखिए।
उत्तर :
जब किसी ऐल्केन के हाइड्रोजन परमाणु को नाइट्रो (-NO2) मूलक द्वारा प्रतिस्थापित करते हैं, तो नाइट्रोऐल्केन उत्पाद प्राप्त होता है। इस प्रकार के प्रतिस्थापन को नाइट्रीकरण कहते हैं।
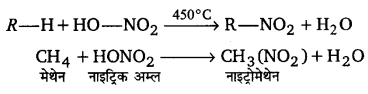
सामान्यतया ऐल्केन नाइट्रिक अम्ल के साथ साधारण परिस्थितियों में कोई अभिक्रिया नहीं दर्शाते हैं। लेकिन उच्च ताप पर जब ऐल्केन व नाइट्रिक अम्ल के वाष्पों को अधिक ताप (300-450°C) पर गर्म किया जाता है, तो नाइट्रोऐल्केन प्राप्त होते हैं। इस अभिक्रिया को वाष्प नाइट्रीकरण कहते हैं।
प्रश्न 24.
आप कार्बनिक यौगिक में कार्बन और हाइड्रोजन की पहचान कैसे करेंगे?
उत्तर :
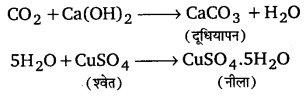
किसी यौगिक में कार्बन तथा हाइड्रोजन की उपस्थिति की जाँच एक ही परीक्षण द्वारा हो जाती है। इस परीक्षण में यौगिक को कॉपर (II) ऑक्साइड के साथ गर्म करते हैं। ऐसा करने पर यौगिक में उपस्थित कार्बन तथा हाइड्रोजन क्रमशः डाइऑक्साइड तथा जल में परिवर्तित हो जाते हैं।
कार्बन डाइऑक्साइड चूने के पानी (lime water) को दूधिया (milky) कर देती है और जल निर्जल कॉपर सल्फेट को नीला कर देता है।
प्रश्न 25.
आप कार्बनिक यौगिक में सल्फर की पहचान कैसे करेंगे?
उत्तर :
किसी कार्बनिक यौगिक में सल्फर की उपस्थिति की जाँच निम्न परीक्षणों के द्वारा की जाती है।
1. ऑक्सीकरण परीक्षण कार्बनिक यौगिक को पोटैशियम नाइट्रेट और सोडियम कार्बोनेट के मिश्रण के साथ संगलित करते हैं। इससे उसमें उपस्थित सल्फर सल्फेट में ऑक्सीकृत हो जाता। है।
संगलित पदार्थ को जल के साथ निष्कर्षित करके इसे उबालते हैं और फिर इसे छान लेते हैं। निस्वंद में सोडियम सल्फेट होता है। निस्वंद में तनु हाइड्रोक्लोरिक अम्ल डालकर उसे अम्लीकृत करते हैं और फिर उसमें बेरियम सल्फेट विलयन डालते हैं। सफेद अवक्षेप की प्राप्ति यौगिक में सल्फर की उपस्थिति दर्शाती है।
2. लैंसे परीक्षण–सर्वप्रथम लैंसे निष्कर्ष तैयार करते हैं। यदि यौगिक में सल्फर उपस्थित होता है। तो वह सोडियम से अभिक्रिया करके सोडियम सल्फाइड बनाता है।
अतः लैंसे निष्कर्ष में सोडियम सल्फाइडे उपस्थित होता है। अब इस निष्कर्ष को दो भागों में बाँट देते हैं। पहले भाग को तनु ऐसीटिक अम्ल से अम्लीकृत करके उसमें लेड ऐसीटेट विलयन की कुछ बूंदें मिलाते हैं। यदि काला अवक्षेप प्राप्त होता है तो यह यौगिक में सल्फर की उपस्थिति को दर्शाता है।
लैंसे निष्कर्ष के दूसरे भाग में सोडियम नाइट्रोभुसाइड की कुछ बूंदें डालते हैं। यदि विलयन बैंगनी हो जाता है तो यह यौगिक में सल्फर की उपस्थिति को दर्शाता है।
प्रश्न 26.
आप कार्बनिक यौगिकों में हैलोजनों की पहचान कैसे करेंगे?
उत्तर :
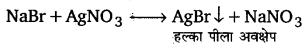
किसी कार्बनिक यौगिक में हैलोजनों की जाँच निम्न परीक्षणों द्वारा की जाती है-
1. बेलस्टीन परीक्षण–एक साफ कॉपर के तार को बुन्सन बर्नर की ऑक्सीकारी ज्वाला में तब तक गर्म करते हैं जब तक कि वह ज्वाला को हरा या नीला रंग देना बंद नहीं कर देता। अब इस गर्म तार को यौगिक में डुबाकर दोबारा से बुन्सन बर्नर की ज्वाला में गर्म करते हैं। ज्वाला का रंग दोबारा से हरा या नीला हो जाना यौगिक में हैलोजनों की उपस्थिति दर्शाता है। इस परीक्षण की कुछ सीमाएँ भी हैं। इस परीक्षण द्वारा यह पता नहीं चलता है कि यौगिक में कौन-सा हैलोजन है। दूसरे, कुछ ऐसे पदार्थ जिनमें हैलोजन नहीं होते हैं, वे भी यह परीक्षण देते हैं। यूरिया, थायोयूरिया आदि ऐसे पदार्थों के उदाहरण हैं।
2. लैंसे परीक्षण–इस परीक्षण के लिए पहले लैंसे निष्कर्ष तैयार करते हैं। लैंसे निष्कर्ष तैयार करने में जब कार्बनिक यौगिक को सोडियम के साथ संगलित करते हैं तब कार्बनिक यौगिक में उपस्थित हैलोजन सोडियम के साथ संयोग करके सोडियम हैलाइड बनाते हैं। ये सोडियम हैलाइड लैंसे निष्कर्ष में उपस्थित होते हैं।
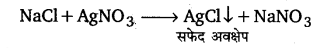
लैंसे निष्कर्ष के एक भाग को तनु नाइट्रिक अम्ल के साथ उबालकर तथा फिर उसे ठण्डा करके उसमें सिल्वर नाइट्रेट विलयन की कुछ बूंदें मिलाते हैं। अवक्षेप का बनना हैलोजन की उपस्थिति दर्शाता है।
अवक्षेप अवक्षेप के रंग और उसकी अमोनियम हाइड्रॉक्साइड में विलेयता के आधार पर कार्बनिक यौगिक में उपस्थित हैलोजन की पहचान की जाती है।
1. सफेद अवक्षेप बनता है जो अमोनियम हाइड्रॉक्साइड में घुल जाता है—क्लोरीन उपस्थित
2. हल्का पीला अवक्षेप जो अमोनियम हाइड्रॉक्साइड में कम घुलता है—ब्रोमीन उपस्थित
3. गहरा पीला अवक्षेप जो अमोनियम हाइड्रॉक्साइड विलयन में बिल्कुल भी नहीं घुलता हैआयोडीन उपस्थित
3. कार्बन डाइसल्फाइड परीक्षण–इस परीक्षण का प्रयोग ब्रोमीन और आयोडीन की जाँच के लिए किया जाता है। इसमें लैंसे निष्कर्ष को नाइट्रिक अम्ल से अम्लीकृत करके उसमें क्लोरीन जल की कुछ बूंदें डाल देते हैं। फिर इस विलयन में कार्बन डाइसल्फाइड या कार्बन टेट्राक्लोराइड मिलाकर इसे हिलाते हैं। कार्बन डाइसल्फाइड या कार्बन टेट्राक्लोराइड पर्त का नारंगी रंग यौगिक में ब्रोमीन की उपस्थिति दर्शाता है जबकि इसका बैंगनी रंग यौगिक में आयोडीन की उपस्थिति दर्शाता है।
अम्लीकृत लैंसे निष्कर्ष (सोडियम हैलाइड) में क्लोरीन जल डालने पर मुक्त Br2 और I2 उत्सर्जित होती हैं जो कार्बन डाइसल्फाइड यो कार्बन टेट्राक्लोराइड में घुलकर उन्हें क्रमशः नारंगी (orange) तथा बैंगनी (violet) रंग प्रदान करती हैं।
2NaBr+Cl2 → 2NaCl+ Br2 (CS2 या CCl4 में नारंगी रंग)
2Nal+Cl2 → 2NaCl + I2 (CS2, या CCl4 में बैंगनी रंग)
प्रश्न 27.
आप कार्बनिक यौगिक में ऑक्सीजन व फॉस्फोरस की पहचान कैसे करेंगे?
उत्तर :
ऑक्सीजन की पहचान–किसी कार्बनिक यौगिक में ऑक्सीजन की उपस्थिति की जाँच के लिए कोई प्रत्यक्ष विधि उपलब्ध नहीं है। इसकी जाँच सामान्यत: निम्नांकित अप्रत्यक्ष विधियों द्वारा की जाती है।
- कार्बनिक यौगिकों की ऑक्सीजन युक्त क्रियात्मक समूहों –OH, COOH, CHO,—NO, के लिए जाँच करते हैं। यदि किसी यौगिक में इनमें से कोई क्रियात्मक समूह उपस्थित होता है तो यह यौगिक में ऑक्सीजन की उपस्थिति दर्शाता है।
- कार्बनिक यौगिक में उपस्थित अन्य तत्त्वों की प्रतिशतताएँ ज्ञात करते हैं। यदि इन प्रतिशतताओं का योग 100 से कम होता है तो यह यौगिक में ऑक्सीजन की उपस्थिति दर्शाता है। इनका अंतर यौगिक में ऑक्सीजन का प्रतिशत बताता है।
- फॉस्फोरस की पहचान–कार्बनिक यौगिक को सोडियम परॉक्साइड (ऑक्सीकारक) के साथ संगलित करते हैं जिससे सोडियम फॉस्फेट बनता है। संगलित पदार्थ का जल के साथ निष्कर्षण करके उसे छान लेते हैं। निस्वंद (filtrate) जिसमें सोडियम फॉस्फेट उपस्थित होता है, को सान्द्र नाइट्रिक अम्ल के साथ उबालकर उसमें अमोनियम मॉलिब्डेट विलयन मिलाते हैं। | पीले अवक्षेप अथवा पीले रंग की प्राप्ति कार्बनिक यौगिक में फॉस्फोरस की उपस्थिति दर्शाती है।
प्रश्न 28.
कार्बनिक यौगिक में कार्बन और हाइड्रोजन का निर्धारण कैसे किया जाता है? समझाइए।
उत्तर :
कार्बनिक यौगिकों में कार्बन और हाइड्रोजन का निर्धारण लीबिग की दहन विधि (Liebig’s combustion method) द्वारा किया जाता है। कार्बन और हाइड्रोजन का निर्धारण एक ही प्रयोग द्वारा हो जाता है। इसमें कार्बनिक यौगिक की ज्ञात मात्रा को शुद्ध शुष्क ऑक्सीजन (आर्द्रता और कार्बन डाइऑक्साइड रहित) के वातावरण में कॉपर (II) ऑक्साइड के साथ गर्म करते हैं। इससे कार्बनिक यौगिक में उपस्थित कार्बन, कार्बन डाइऑक्साइड में तथा हाइड्रोजन, जल में ऑक्सीकृत हो जाते हैं।
उत्पन्न कार्बन डाइऑक्साइड U-नली में लिए गए सान्द्र पोटैशियम हाइड्रॉक्साइड विलयन द्वारा अवशोषित कर ली जाती है जबकि उत्पन्न जल एक अन्य U-नली में लिए गए निर्जल कैल्सियम क्लोराइड द्वारा अवशोषित कर लिया जाता है।
इससे सान्द्र पोटैशियम हाइड्रॉक्साइड विलयन तथा कैल्सियम क्लोराइड के द्रव्यमानों में वृद्धि से क्रमश: कार्बन डाइऑक्साइड और जल की मात्राएँ ज्ञात कर लेते हैं। इनसे कार्बन तथा हाइड्रोजन की, प्रतिशतता की गणना कर लेते हैं।
प्रश्न 29.
कार्बनिक यौगिक में ऑक्सीजन का निर्धारण करने की विधि लिखिए।
उत्तर :
कार्बनिक यौगिक में ऑक्सीजन की प्रतिशतता की गणना कुल प्रतिशतता (100) में से अन्य तत्त्वों की प्रतिशतताओं के योग को घटाकर की जाती है। ऑक्सीजन का प्रत्यक्ष निर्धारण निम्नविधि से भी किया जा सकता है।
कार्बनिक यौगिक की एक निश्चित मात्रा नाइट्रोजन गैस की धारा में गर्म करके अपघटित की जाती है। प्राप्त ऑक्सीजनयुक्त गैसीय मिश्रण को रक्त-तप्त कोक पर प्रवाहित करते हैं जिससे सारी ऑक्सीजन कार्बन मोनो-ऑक्साइड में परिवर्तित हो जाती है। तत्पश्चात् गैसीय मिश्रण को हल्के गर्म आयोडीन पेन्टाऑक्साइड (I2O5) में प्रवाहित करते हैं जिससे कार्बन मोनोऑक्साइड कार्बन डाइऑक्साइड में ऑक्सीकृत हो जाती है और आयोडीन मुक्त होती है।
ऑक्सीजन की प्रतिशतता का आकलन मुक्त कार्बन डाइऑक्साइड अथवा आयोडीन की मात्रा से किया जा सकता है।
प्रश्न 30.
1.05 ग्राम एक कार्बनिक यौगिक की केल्डाल विधि से क्रिया की गयी तथा उत्पन्न NH3 को 100 मिली N/10 H2SO4 में अवशोषित किया गया। बचे हुए अम्ल को उदासीन करने हेतु 10 मिली N/5 NaOH घोल की आवश्यकता हुई। यौगिक में नाइट्रोजन की प्रतिशत मात्रा ज्ञात कीजिए।
उत्तर :
मान लीजिए, V मिली शेष अम्ल N/10 H2SO4 को उदासीन करने में 10 मिली N/5 NaOH लगे,
प्रश्न 31.
एक कार्बनिक यौगिक के 1.195 ग्राम का दहन करने पर 0.44 ग्राम CO2 तथा 0.9 ग्राम जल प्राप्त हुआ। 0.2046 ग्राम यौगिक के दहन पर 15°C ताप तथा 732.7 मिमी दाब पर 30.4 मिली नम नाइट्रोजन प्राप्त हुई। यौगिक में कार्बन, हाइड्रोजन तथा नाइट्रोजन की प्रतिशत मात्रा ज्ञात कीजिए। (15°C ताप पर जलवाष्प दाब 12.7 मिमी) (C= 12, H =1, 0= 16, N=14)
उत्तर :
सूत्रानुसार,
प्रश्न 32.
C, H, N तथा O युक्त एक कार्बनिक यौगिक ने विश्लेषण करने पर निम्नलिखित परिणाम दिये।
(i) यौगिक के 0.25 ग्राम को दहन करने पर 0.368 ग्राम CO2 तथा 0.205 ग्राम जल प्राप्त हुए।
(ii) 0.6 ग्राम यौगिकसे केल्डाल क्रिया द्वारा निकली अमोनिया गैस को 60 मिली H2SO4 में अवशोषित किया गया। अम्ल के आधिक्य को उदासीन करने के लिए 20.0 मिली A कास्टिक पोटाश विलयन की आवश्यकता पड़ी। यौगिक में उपस्थित सभी तत्त्वों की प्रतिशतता ज्ञात कीजिए। (C=12, H = 1, N = 14,0= 16)
उत्तर :
प्रश्न 33.
केरियस विधि द्वारा हैलोजन के आकलन में 0.40 ग्राम कार्बनिक यौगिक से 0.47 ग्राम AgBr प्राप्त हुआ। यौगिक में ब्रोमीन की प्रतिशतता ज्ञात कीजिए। [Ag= 108, Br = 80]
उत्तर :
विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
आप कार्बनिक यौगिक में नाइट्रोजन की पहचान कैसे करेंगे?
या
लैंसे परीक्षण के रसायन का वर्णन कीजिए।
उत्तर :
नाइट्रोजन की पहचान—किसी कार्बनिक यौगिक में नाइट्रोजन की पहचान निम्न परीक्षणों द्वारा की जाती है ।
1. सोडा-लाइम परीक्षण–यौगिक की थोड़ी मात्रा को सोडा-लाइम (NaOH+CaO) के साथ तेज गर्म करते हैं। मिश्रण में से अमोनिया की गंध यौगिक में नाइट्रोजन की उपस्थिति दर्शाती है।
इस परीक्षण की सीमा यह है कि अनेक कार्बनिक यौगिक (जैसे नाइट्रो और डाइएजो यौगिक) इन परिस्थितियों में अमोनिया उत्पन्न नहीं करते हैं।
2. लैंसे परीक्षण–इस परीक्षण का उपयोग न केवल नाइट्रोजन बल्कि अन्य तत्त्वों; जैसे सल्फर और हैलोजनों की उपस्थिति की जाँच के लिए भी किया जाता है। नाइट्रोजन की उपस्थिति की जाँच के लिए यह परीक्षण निम्न दो पदों में किया जाता है।
1. लैंसे निष्कर्ष तैयार करना–सोडियम धातु के एक छोटे से टुकड़े को फिल्टर पेपर द्वारा सुखाकर एक साफ और शुष्क ज्वलन नली (ignition tube) में लेते हैं। इस ज्वलन नली को बुन्सन बर्नर की ज्वाला में धीरे-धीरे गर्म करते हैं। जब सोडियम धातु पिघलकर पारे की तरह चमकने लगता है तब ज्वलन नली में कार्बनिक यौगिक की थोड़ी मात्रा डाल देते हैं। अब ज्वलन नली को पहले धीरे-धीरे और फिर तेजी से गर्म करते हैं। जब ज्वलन नली का नीचे का भाग लाल हो जाता है तब इस रक्त-तप्त नली को चाइना डिश में लिए गए 10-15 mL आसुत जल में डाल देते हैं। चाइना डिश में उपस्थित विलयन को थोड़ी देर उबालकर ठंडा , कर लेते हैं और फिर इसे छान लेते हैं। छानने से प्राप्त हुए निस्वंद (filtrate) को लैंसे निष्कर्ष (Lassaigne’s extract) या सोडियम निष्कर्ष कहते हैं। सोडियम धातु के यौगिक के साथ संगलित होने पर यौगिक में उपस्थित तत्त्व सहसंयोजी रूप से आयनिक रूप में परिवर्तित हो जाते हैं।
2. नाइट्रोजन के लिए परीक्षण-एक परखनली में 1 mL लैंसे निष्कर्ष लेकर उसमें तनु सोडियम हाइड्रॉक्साइड विलयन की कुछ बूंदें डालते हैं। इससे लैंसे निष्कर्ष क्षारकीय हो जाता है। सामान्यतः लैंसे निष्कर्ष की प्रकृति क्षारकीय ही होती है। परखनली में 2 mL ताजा बना हुआ फेरस सल्फेट का सान्द्र विलयन डालकर परखमली को गर्म करते हैं। विलयन को ठंडा करके उसमें कुछ बूंद फेरिक क्लोराइड विलयन डालते हैं और फिर उसमें तनु हाइड्रोक्लोरिक अम्ल डालकर उसे अम्लीय करते हैं।
यदि विलयन का रंग प्रशियन नीला (prusssian blue) हो जाता है तो यह यौगिक में । नाइट्रोजन की उपस्थिति दर्शाता है। परीक्षण में निम्न अभिक्रियाएँ होती हैं।
जब यौगिक में नाइट्रोजन और सल्फर दोनों उपस्थित होते हैं तो संगलन के परिणामस्वरूप’. सोडियम सल्फोसायनाइड बनता है। यह फेरिक आयनों से अभिक्रिया करके रक्त लाल (blood red) रंग का फेरिक सल्फोसायनाइड बनाता है।
उपरोक्त अभिक्रिया में सोडियम सल्फोसायनाइड अपर्याप्त सोडियम के कारण बनता है। जब सोडियम आधिक्य में उपस्थित होता है तो सोडियम सल्फोसायनाइड अपघटित होकर सोडियम सायनाइड और सोडियम सल्फाइड बनाता है।
इस स्थिति में यौगिक में सल्फर के उपस्थित होने पर भी रक्त लाल रंग प्राप्त नहीं होता है। अत: रक्त लाल रंग की अनुपस्थिति से यह निष्कर्ष नहीं निकाला जा सकता है कि यौगिक में सल्फर अनुपस्थित है।]
एनसीईआरटी सोलूशन्स क्लास 11 रसायन विज्ञान पीडीएफ
- 1. रसायन विज्ञान की कुछ मूल अवधारणाएं
- 2. परमाणु की संरचना
- 3. तत्वों का वर्गीकरण तथा गुणधर्मो में आवर्तिता
- 4. रासायनिक आबंधन तथा आण्विक संरचना
- 5. द्रव्य की अवस्थाएं
- 6. ऊष्मागतिकी
- 7. साम्यावस्था
- 8. अपचयोपचय अभिक्रियाएँ
- 9. हाइड्रोजन
- 10. S - ब्लॉक के तत्व
- 11. P - ब्लॉक के तत्व
- 13. हाइड्रोकार्बन
- 14. पर्यावरणीय रसायन